Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Amine SVIP
I. Khái niệm, phân loại và danh pháp
1. Khái niệm
Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
Tương tự như ammonia, nguyên tử nitrogen trong phân tử amine tạo ba liên kết cộng hóa trị với hydrogen hoặc gốc hydrocarbon. Ngoài ra, nguyên tử nitrogen này còn một cặp electron hóa trị riêng. Dạng hình học phân tử của ammonia, amine và mô hình phân tử một số amine được mô tả như sau:
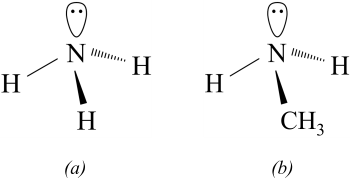
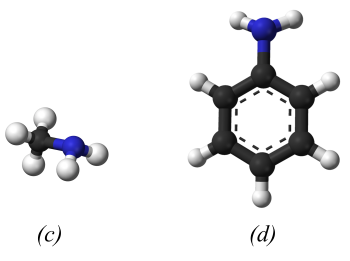
2. Phân loại
Amine thường được phân loại theo bậc của amine hoặc bản chất gốc hydrocarbon.
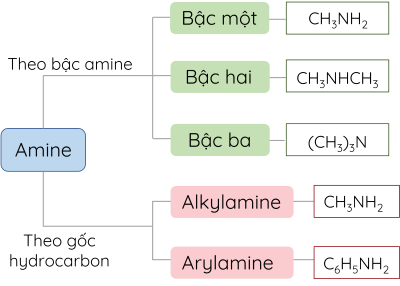
3. Danh pháp
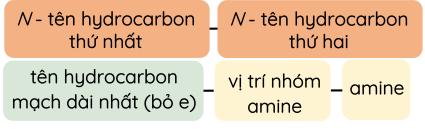
Theo danh pháp gốc – chức, tên của amine được hình thành từ tên của các gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen kèm theo tên chức amine.
Theo danh pháp thay thế, các amine đơn chức được gọi tên như sau:
- Amine bậc một:

- Amine bậc hai:
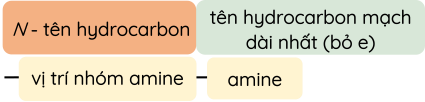
- Amine bậc ba:
@203193870847@
|
Amine |
Tên gốc - chức | Tên thay thế |
|
CH3NH2 |
methylamine | methanamine |
|
CH3CH2NH2 |
ethylamine |
ethanamine |
|
CH3NHCH3 |
dimethylamine |
N-methylmethanamine |
|
CH3CH2CH2NH2 |
propylamine |
propan-1-amine |
|
CH3CH2NHCH3 |
ethylmethylamine |
N-methylethanamine |
|
(CH3)2CHNH2 |
isopropylamine |
propan-2-amine |
|
(CH3)3N |
trimethylamine |
N,N-dimethylmethanamine |
II. Tính chất vật lí
Methylamine, ethylamine, dimethylamine và trimethylamine là những chất khí ở điều kiện thường, các amine có phân tử khối lớn hơn là chất lỏng hoặc chất rắn.
Các amine có khối lượng phân tử thấp thường có mùi tanh khó chịu (giống mùi tanh của cá).
Amine có nhiệt độ sôi cao hơn hydrocarbon có cùng số nguyên tử carbon hoặc có phân tử khối tương đương.
Các amine có số nguyên tử carbon nhỏ thường tan tốt trong nước nhờ tạo được liên kết hydrogen với nước. Khi số nguyên tử carbon trong gốc hydrocarbon tăng thì độ tan của các amine giảm.
Các arylamine có độ tan trong nước rất thấp.
III. Tính chất hóa học
Nguyên tử nitrogen trong phân tử amine có cặp electron hóa trị riêng nên amine có tính base tương tự ammonia:
\(RNH_2+H_2O⇌RNH_3^++OH^-\)
Bên cạnh đó, nguyên tử nitrogen trong phân tử amine có số oxi hóa là -3 nên amine thường dễ bị oxi hóa. Ngoài ra, các amine còn có một số tính chất gây ra bởi gốc hydrocarbon trong phân tử.
1. Tính base và phản ứng tạo phức
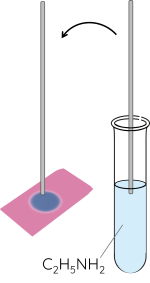
Thí nghiệm: Tính base của amine
- Dùng đũa thủy tinh nhúng vào dung dịch ethyalamine rồi chấm vào mẩu giấy quỳ tím.
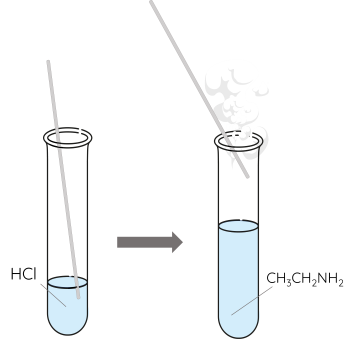
- Nhúng đũa thủy tinh sạch vào dung dịch HCl đặc rồi đưa đầu ống thủy tinh vào ống nhiệm chứa khoảng 1 mL dung dịch ethylamine 5%.
- Thêm khoảng 2 mL dung dịch ethylamine 5% vào ống nghiệm chứa khoảng 5 giọt dung dịch FeCl3 3%.

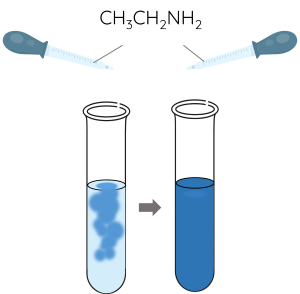
- Thêm từ từ đến hết 4 mL dung dịch ethylamine 5% vào ống nghiệm chứa khoảng 5 giọt dung dịch CuSO4 5%.
Dung dịch aniline trong nước không làm đổi màu quỳ tím, trong khi dung dịch các alkylamine có thể làm quỳ tím hóa xanh. Amine tác dụng với acid tạo thành muối. Các amine có khối lượng phân tử nhỏ có khả năng tác dụng với dung dịch muối của một số kim loại tạo thành kết tủa hydroxide.
Ví dụ 1:
\(CH_3CH_2NH_2+HCl\rightarrow C_2H_5NH_3Cl\)
\(FeCl_3+3C_2H_5NH_2+3H_2O\rightarrow Fe\left(OH\right)_3+3C_2H_5NH_3Cl\)
Các amine như methylamine hay ethylamine tác dụng với Cu(OH)2 tạo dung dịch phức chất có màu xanh lam.
Ví dụ 2:
\(Cu\left(OH\right)_2+4C_2H_5NH_2\rightarrow\left[Cu\left(C_2H_5NH_2\right)_4\right]\left(OH\right)_2\)
2. Tính khử
Alkylamine bậc một tác dụng với nitrous acid ở nhiệt độ thường tạo thành alcohol và giải phóng khí nitrogen.
Ví dụ 3:
\(CH_3NH_2+HONO\rightarrow CH_3OH+N_2+H_2O\)
Aniline tác dụng với nitrous acid ở nhiệt độ thấp (0 – 5 oC) tạo thành muối diazonium.
Ví dụ 4:
\(C_6H_5NH_2+HONO+HCl\overset{0-5^oC}{\rightarrow}\left[C_6H_5N_2\right]^+Cl^-+2H_2O\)
3. Phản ứng thế ở nhân thơm của aniline
Thí nghiệm: Phản ứng bromine hóa aniline
Thêm 1 mL dung dịch aniline loãng vào ống nghiệm chứa khoảng 0,5 - 1 mL nước bromine, vừa thêm vừa lắc.
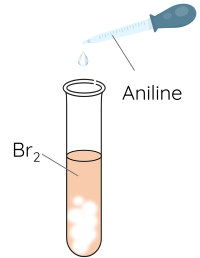
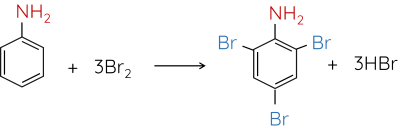
Nhóm -NH2 trong phân tử aniline làm tăng mật độ electron trong vòng benzene (tương tự nhóm -OH trong phân tử phenol), đặc biệt ở các vị trí ortho và para. Aniline dễ tham gia phản ứng với nước bromine tạo 2,4,6-tribromoaniline kết tủa trắng.
IV. Ứng dụng và điều chế
1. Ứng dụng
Hợp chất có nhóm chức amine được thấy trong thành phần của nhiều dược phẩm, thuốc bảo vệ thực vật,...
Aniline là nguyên liệu quan trọng để tổng hợp phẩm nhuộm (phẩm màu azo, aniline đen,...), chất hoạt động bề mặt. Aniline và các diamine (như hexamethylenediamine) được dùng để tổng hợp polymer (nhựa poly(aniline-formaldehyde), tơ nylon-6,6,...).

2. Điều chế
a) Alkyl hóa ammonia
Alkylamine được điều chế từ ammonia và dẫn xuất halogen. Tùy thuộc vào tỉ lệ mol các chất tham gia phản ứng, có thể thu được sản phẩm là amine bậc một, bậc hai hoặc bậc ba.
Ví dụ 5:
\(NH_3\xrightarrow[+CH_3Br]{-HBr}NH_2\left(CH_3\right)\xrightarrow[+CH_3Br]{-HBr}NH\left(CH_3\right)_2\xrightarrow[+CH_3Br]{-HBr}N\left(CH_3\right)_3\)
b) Khử hợp chất nitro
Aniline và các arylamine thường được điều chế bằng cách khử hợp chất nitrobenzene (hoặc dẫn xuất nitro tương ứng) bởi một số kim loại (Zn, Fe,...) trong dung dịch HCl.
Ví dụ 6:
\(C_6H_5NO_2+6\left[H\right]\xrightarrow[t^o]{Fe+HCl}C_6H_5NH_2+2H_2O\)
1. Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon. Có thể phân loại amine theo bậc amine (amine bậc một, bậc hai và bậc ba) hoặc theo đặc điểm cấu tạo gốc hydrocarbon (alkylamine và arylamine).
2. Amine có tính base yếu; một số amine như methylamine, ethylamine tạo được hợp chất phức với Cu2+; các alkylamine bậc một phản ứng với HNO2 tạo thành alcohol và giải phóng N2; Aniline phản ứng với HNO2 ở nhiệt độ thấp tạo muối diazonium; aniline dễ tham gia phản ứng thế nguyên tử H của vòng benzene hơn so với benzene.
3. Các amine được điều chế bằng cách alkyl hóa ammonia hoặc khử hợp chất nitro.
4. Các amine là nguyên liệu cho công nghiệp tổng hợp phẩm nhuộm, dược phẩm, polymer và tơ sợi.
Bạn có thể đăng câu hỏi về bài học này ở đây
