Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
∆ H < 0 : phản ứng thuận là phản ứng tỏa nhiệt
(1) Tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt (tức chiều nghịch).
(2) Tăng áp suất chung của hệ phản ứng cân bằng chuyển dịch theo chiều làm giảm số mol khí (tức chiều thuận).
(3) Hạ nhiệt độ cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt (tức chiều thuận)
(4) Chất xúc tác không làm cân bằng chuyển dịch.
(5) Giảm nồng độ S O 3 cân bằng chuyển dịch theo chiều tăng nồng độ (tức chiều thuận)
(6) Giảm áp suất chung của hệ phản ứng cân bằng chuyển dịch theo chiều tăng số mol khí (tức chiều nghịch).

A. Bất cứ phản ứng nào cũng chỉ vận dụng được một trong các yếu tố ảnh hưởng đến tóc độ phản ứng để tăng tốc độ phản ứng.
B. Bất cứ phản ứng nào cũng phải vận dụng đủ các yếu tố ảnh hưởng đến tốc độ phản ứng mới tăng được tốc độ phản ứng.
C. Tùy theo phản ứng mà vận dụng một, một số hay tất cả các yêu tố ảnh hưởng đến tốc độ phản ứng để tăng tốc độ phản ứng.
D. Bất cứ phản ứng nào cũng cần chất xúc tác để tăng tốc độ phản ứng.

Chọn A. Vì trong phản ứng trên, Cu đóng vai trò là chất oxi hóa (nhận thêm e) và sau phản ứng, số oxi hóa của Cu giảm.
\(Cu^{+2}+2e\rightarrow Cu^0\)
1 (mol) ----> 2 (mol)

Chọn đáp án D
Các yếu tố ảnh hưởng đến cân bằng hóa học
+ Nhiệt độ:
Đối với phản ứng tỏa nhiệt (DH < 0) : Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều nghịch, giảm nhiệt độ cân bằng chuyển dịch sang chiều thuận
Đối với phản ứng thu nhiệt (DH > 0) : Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều thuận, khi giảm nhiệt độ cân bằng chuyển dịch sang chiều nghịch.
+ Nồng độ:
Khi giảm nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều tạo ra chất đó, ngược lại, khi tăng nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều làm giảm nồng độ của chất đó.
+ Áp suất:
Khi tăng áp suất cân bằng sẽ chuyển dịch sang chiều giảm số phân tử khí, khi giảm áp suất cân bằng sẽ chuyển dịch sang chiều tăng số phân tử khí. ( nếu số mol khí 2 bên bằng nhau thì áp suất không ảnh hưởng đến chiều phản ứng)
Chú ý: chất xúc tác chỉ có tác dụng làm tăng tốc độ phản ứng chứ không làm thay đổi chiều phản ứng.
Vậy các biện pháp (2), (3), (5) sẽ làm cân bằng trên chuyển dịch theo chiều thuận.

Đáp án B
Các yếu tố ảnh hưởng đến cân bằng hóa học
+ Nhiệt độ:
Đối với phản ứng tỏa nhiệt (rH < 0): Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều nghịch, giảm nhiệt độ cân bằng chuyển dịch sang chiều thuận
+ Nồng độ:
Khi giảm nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều tạo ra chất đó, ngược lại, khi tăng nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều làm giảm nồng độ của chất đó.
+ Áp suất:
Khi tăng áp suất cân bằng sẽ chuyển dịch sang chiều giảm số phân tử khí, khi giảm áp suất cân bằng sẽ chuyển dịch sang chiều tăng số phân tử khí.
Chú ý: Chất xúc tác chi có tác dụng làm tăng tốc độ phản ứng chứ không làm chuyển dịch cân bằng

Đáp án B
Các yếu tố ảnh hưởng đến cân bằng hóa học
+ Nhiệt độ:
Đối với phản ứng tỏa nhiệt (rH < 0): Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều nghịch, giảm nhiệt độ cân bằng chuyển dịch sang chiều thuận
+ Nồng độ:
Khi giảm nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều tạo ra chất đó, ngược lại, khi tăng nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều làm giảm nồng độ của chất đó.
+ Áp suất:
Khi tăng áp suất cân bằng sẽ chuyển dịch sang chiều giảm số phân tử khí, khi giảm áp suất cân bằng sẽ chuyển dịch sang chiều tăng số phân tử khí.
Chú ý: Chất xúc tác chi có tác dụng làm tăng tốc độ phản ứng chứ không làm chuyển dịch cân bằng

Đáp án D.
Tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch (do phản ứng tỏa nhiệt).
Chất xúc tác không làm chuyển dịch cân bằng hóa học.
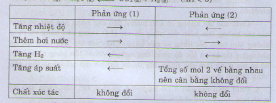
.jpg)
Chọn B
∆ H > 0 phản ứng thuận thu nhiệt.
(1) Tăng nhiệt độ của phản ứng cân bằng chuyển dịch theo chiều phản ứng thu nhiệt tức chiều thuận.
(2) Tăng áp suất chung của hệ không làm ảnh hưởng đến cân bằng do số mol khí ở hai vế của phương trình hóa học bằng nhau.
(3) Giảm nhiệt độ của phản ứng cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt tức chiều nghịch.
(4) Tăng số mol CO cân bằng chuyển dịch theo chiều làm giảm CO tức chiều thuận.
→ Vậy có hai biện pháp (1) và (4) làm tăng hiệu suất của hệ phản ứng.