Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Xét các phát biểu:
(1) Khi tăng nhiệt độ số mol X giảm, nghĩa là chuyển dịch theo chiều thuận → phản ứng thuận là phản ứng thu nhiệt → (1) đúng.
(2) Khi tăng áp suất thì cân bằng chuyển dịch theo chiều làm giảm áp suất → cân bằng chuyển dịch theo chiều nghịch →(2) đúng
(3) Thêm Y vào thì cân bằng chuyển dịch theo chiều giảm Y nghĩa là cân bằng chuyển dịch theo chiều nghịch → (3) đúng
(4) Xúc tác không làm ảnh hưởng đến chuyển dịch mà chỉ làm thay đổi tốc độ phản ứng →(4) đúng
Chọn đáp án D.

C.Sự có mặt chất xúc tác. Chất xúc tác làm tăng tốc độ phản ứng thuận và tốc đọ phản ứng nghịch với số lần bằng nhau. Do vậy, chất xúc tác không làm chuyển dịch cân bằng hóa học hay không làm nồng độ các chất trong cân bằng biến đổi

Chọn B
∆ H < 0 : phản ứng thuận là phản ứng tỏa nhiệt
(1) Tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt (tức chiều nghịch).
(2) Tăng áp suất chung của hệ phản ứng cân bằng chuyển dịch theo chiều làm giảm số mol khí (tức chiều thuận).
(3) Hạ nhiệt độ cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt (tức chiều thuận)
(4) Chất xúc tác không làm cân bằng chuyển dịch.
(5) Giảm nồng độ S O 3 cân bằng chuyển dịch theo chiều tăng nồng độ (tức chiều thuận)
(6) Giảm áp suất chung của hệ phản ứng cân bằng chuyển dịch theo chiều tăng số mol khí (tức chiều nghịch).

Chọn đáp án D
Các yếu tố ảnh hưởng đến cân bằng hóa học
+ Nhiệt độ:
Đối với phản ứng tỏa nhiệt (DH < 0) : Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều nghịch, giảm nhiệt độ cân bằng chuyển dịch sang chiều thuận
Đối với phản ứng thu nhiệt (DH > 0) : Khi tăng nhiệt độ cân bằng chuyển dịch sang chiều thuận, khi giảm nhiệt độ cân bằng chuyển dịch sang chiều nghịch.
+ Nồng độ:
Khi giảm nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều tạo ra chất đó, ngược lại, khi tăng nồng độ của một chất cân bằng sẽ chuyển dịch sang chiều làm giảm nồng độ của chất đó.
+ Áp suất:
Khi tăng áp suất cân bằng sẽ chuyển dịch sang chiều giảm số phân tử khí, khi giảm áp suất cân bằng sẽ chuyển dịch sang chiều tăng số phân tử khí. ( nếu số mol khí 2 bên bằng nhau thì áp suất không ảnh hưởng đến chiều phản ứng)
Chú ý: chất xúc tác chỉ có tác dụng làm tăng tốc độ phản ứng chứ không làm thay đổi chiều phản ứng.
Vậy các biện pháp (2), (3), (5) sẽ làm cân bằng trên chuyển dịch theo chiều thuận.

Đáp án D
Ta có:![]()
Gọi nồng độ N2 phản ứng là x(M)
Phản ứng 2NH3 (k) D N2 (k) + 3H2 (k)
Ban đầu 1 0 0
Phản ứng 2x x 3x
Cân bằng (1-2x) x 3x
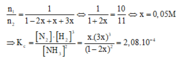

Đáp án D
Ta có: n 1 n 2 = p 1 p 2 x T 2 T 1 = 1 3 , 3 = 546 + 273 0 + 273 = 10 11
Gọi nồng độ N2 phản ứng là x(M)
Phản ứng 2NH3 (k) D N2 (k) + 3H2 (k)
Ban đầu 1 0 0
Phản ứng 2x x 3x
Cân bằng (1-2x) x 3x
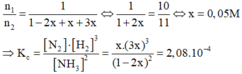

Đáp án C
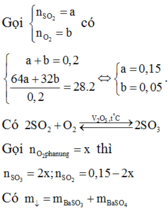
Áp suất sau bằng áp suất trước phản ứng nên số mol khí phản ứng bằng số mol khí tạo thành
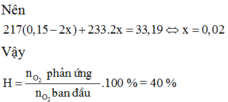

\(2SO_2+O_2\underrightarrow{^{to,xt}}2SO_3\)
* \(n_{SO2}=\frac{P.V}{R.T}\)
\(\Rightarrow n_{SO2}=\frac{n.R.T}{P}\)
\(=\frac{0,15.0,082.250}{3,2}=0,96\left(l\right)\)
* \(n_{SO3}=\frac{P.V}{R.T}\)
\(\Rightarrow V_{SO3}=\frac{n.R.T}{P}=\frac{0,2.0,082.250}{3,2}=1,28\left(l\right)\)
* \(V_{O2}=3-V_{SO2}-V_{SO3}=0,76\left(l\right)\)
\(\Rightarrow\%V_{O2}=\frac{0,76}{3}.100\%=25,3\%\)