Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe\left(NO_3\right)_3}=0,14mol\)
Đặt \(n_{Fe}=n_{FeO}=n_{Fe_2O_3}=n_{Fe_3O_4}=x\)
\(Fe\rightarrow Fe^{3+}\)
x x
\(FeO\rightarrow Fe^{3+}\)
x x
\(Fe_2O_3\rightarrow2Fe^{3+}\)
x 2x
\(Fe_3O_4\rightarrow3Fe^{3+}\)
x 3x
\(\Rightarrow7x=0,14\Rightarrow x=0,02\Rightarrow m=10,4g\)

Định hướng tư duy giải
Ta có:
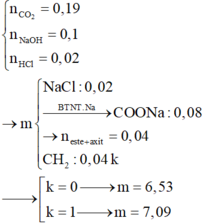
Ta làm trội C: Khi cho k = 0 thì số COO cháy cho 0,08 mol CO2 → ancol cháy cho 0,11 mol CO2
→ n = 0 , 11 0 , 05 > 2
=> Vô lý vì Mtb< 46 → ntb <2 → m = 7,09(gam).

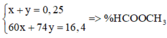


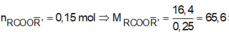
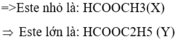
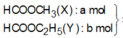
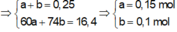


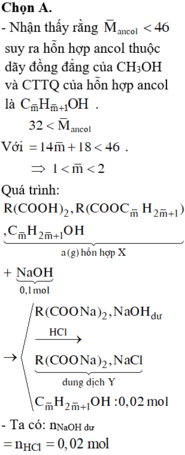



Chọn đáp án B
Ta có nNaOH = 0,25 mol.
Mtrung bình của este = 16,4 : 0,25
= 65,6
Do đó có một este là HCOOCH3
Cô cạn dung dịch thu được hỗn hợp hai ancol đồng đẳng kế tiếp và một muối
⇒ Este còn lại là HCOOCH2CH3.
Lập hpt ta tính được n H C O O C H 3 = 0 , 15 m o l
% m H C O O C H 3 = 0 , 15 × 60 16 , 4 = 54 , 878 %