Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1. Theo bài ra, hóa trị của X trong hợp chất với hiđro là II nên hóa trị cao nhất trong oxit là VI.
Vậy X thuộc chu kỳ 3, nhóm VIA trong bảng tuần hoàn. X là S.
2. Các phương trình phản ứng:
H2S + 4Cl2 + 4H2O H2SO4 + 8HCl
H2S + 2FeCl3 2FeCl2 + S + 2HCl
H2S + CuSO4 CuS + H2SO4
Đc chx cj hai

Câu 1 : \(\%_H=\frac{3}{R+3}\cdot100=17.65\)
\(\Rightarrow R=14\)
Vậy R là N(Nitơ)
Câu 2:
Nguyên tố X có hóa trị cao nhất với Oxi gấp 3 lần so vs hc của Hidro nên X thuộc nhóm VIA
hóa trị cao nhất vs Oxi là XO3
mà tỉ khối hơi so với Nitơ là 2.875 tức MXO3 =80.5
MX=32.5
Vậy X là S(Lưu huỳnh)
1.
\(\text{% R= 100-% H= 100-17,65 = 82.35 %}\)
Ta có :
\(\frac{MR}{\%R}=\frac{MH}{\%H}\Rightarrow\frac{MR}{82,35}=\frac{3}{17,65}\)
\(\Rightarrow MR=13,99\approx14\left(đvC\right)\)
\(\rightarrow\)R là nitơ (NH3)
2.
Hóa trị của X vs oxi, hidro lần lượt là x,y
\(\Rightarrow\left\{{}\begin{matrix}\text{x + y = 8}\\\text{x =3y}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{x = 6}\\\text{y = 2}\end{matrix}\right.\)
Hợp chất của X vs oxi là XO3
\(\rightarrow\text{M(XO3) = 2,857.28=80}\)
\(\rightarrow\text{X = 32 }\)
\(\rightarrow\)Lưu huỳnh(S)
3.
Hợp chất của R vs Oxi là R2O5
\(\%R=\frac{2R}{\left(2R+16.5\right)}\text{= 0,4366}\)
\(\rightarrow R=31\left(\frac{g}{mol}\right)\)
\(\rightarrow\) R là Photpho
4.
Y tạo vs Oxi hợp chất YO3
\(\rightarrow\) Y tạo vs H hợp chất H2Y
Và Y ở chu kì 3\(\rightarrow\) Y là S
\(\%M=\frac{M}{\left(M+2.32\right)}\text{ = 0,4667}\)
\(\rightarrow\text{M = 56}\)
\(\Rightarrow\)M là Sắt(Fe)
Lần sau bn đăng tách câu hỏi ra cho dễ nhìn nhé

HD:
CT oxit cao nhất của R với oxi là R2O5 (suy ra từ RH3).
Ta có: 80/(2R+80) = 0,5634 suy ra: R = 14 (N).
H:N:H H cấu tạo: H-N-H H
Hóa trị cao nhất vs khí H là 3
>> hóa trị cao nhất vs O là 8_3=5
>>hợp chất vs oxit cao nhất là R2O5
Có %mO=56.34%
Xét tỉ số MO/Mo+MR =%mo
Hay80/80+2×MR=0.5634
>>MR=14(N)
>>hợp chất vs oxit cao nhất là N2O5
b) hợp chất vs H là NH3

1.
Oxit cao nhất của R là R2O5 → R thuộc nhóm VA
Hợp chất khí của R với H là RH3 trong đó:
\(\%H=\frac{3.1}{3.1+M_R}.100\%=17,65\%\)
\(\rightarrow M_R=14\)
→ R là nito
2.
Oxit cao nhất của R là R2O7 → R thuộc nhóm VIIA
Hợp chất khí của R với H là HR trong đó:
\(\%H=\frac{1.1}{1.1+M_R}.100\%=2,74\%\)
\(\rightarrow M_R=35,5\)
→ R là Clo

Oxit cao nhất của một nguyên tố là RO3, theo bảng tuần hoàn suy ra công thức hợp chất khí với hiđro của nó là RH2, trong phân tử RH2, có 5,88% H về khối lượng
nên R có 100 - 5,88 = 94,12% về khối lượng
Trong phân tử RH2, có: 5,88% H là 2u
94,12% R là x u
Giải ra ta có x ≈ 32. Nguyên tử khối của R = 32. R là S. Công thức phân tử là SO3 và H2S.

Bạn tham khảo lời giải ở đây nhé!
Câu hỏi của Huong LE - Hóa học lớp 8 | Học trực tuyến
Từ đó suy ra A là N2O5 và B là NH3.

nFe = x mol, nCu = y mol.
Cho toàn bộ Z vào dung dịch H2SO4 (loãng, dư),
sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa
một muối duy nhất. ==> chất rắn Z gồm Fe dư và Cu , khi cho qua H2SO4 loãng chất rắn giảm chính là Fe dư vì Cu ko phản ứng vs H2SO4 lãng mà dd sau đó lại chỉ chứa 1 muối.
nFe(dư) = 0,28/56 = 0,005 mol.
vì khi cho Fe vào Zn và dd CuSO4 Zn fản ứng hết thì mới tới Fe
và 1mol Fe---> 1mol Cu mhh tăng 8g , 1mol Zn ---> 1mol Cu mhh giảm 1 gam.
dùng tăng giảm khối lượng : (x - 0,005).8 - y = 0,14 (1)
và tổng khối lượng hh ban đầu = 2,7 ==> 56x + 65y = 2,7(2)
giải (1) và (2) ra x = 0,025 và y = 0,02.
%Fe = 0,025.56/(0,025.56 + 0,02.64). 100 = 52,24%
vì mZ >mX nên Zn phản ứng hết, Fe phản ứng 1 phần
gọi x, y là mol của Zn và Fe
theo đề bài ta có:
65x +56y+0,28= 2,7 (1)
64(x+y)+0,28=2,84 (2)
từ (1),(2)=>x=0,02
y=0,02
%mFe = (56.0,02+0,28)/2,7=51,85%
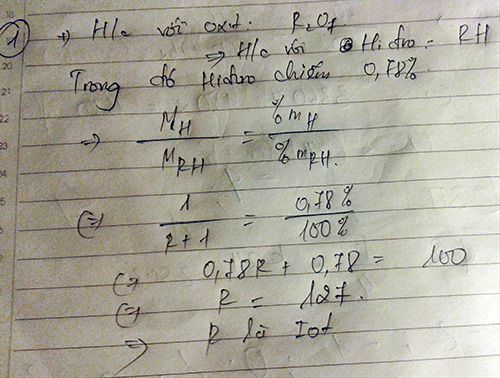
1. Theo bài ra, hóa trị của X trong hợp chất với hidro là II nên hóa trị cao nhất trong oxit là VI.
Vậy X thuộc chu kỳ 3, nhóm VIA trong bảng tuần hoàn.
2. R thuộc nhóm VI nên hóa trị cao nhất trong oxit là VI, vậy công thức oxit cao nhất có dạng RO3. Trong oxit này R chiếm 40% khối lượng nên:
MR = 32.
3. X là S. Các phương trình phản ứng:
H2S + 4Cl2 + 4H2O \(\rightarrow\) H2SO4 + 8HCl
H2S + 2FeCl3 \(\rightarrow\) 2FeCl2 + S + 2HCl
H2S + CuSO4 \(\rightarrow\)CuS + H2SO4
Bài này thì có j khó đâu