Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nOH- = 0,04 mol
Vì nAlO2- = 0,02 mol mà chỉ thu được 0,01 mol kết tủa nên nHCl = 4n kết tủa + nAlO2- dư = 0,05 mol
=> tổng nH+ = 0,09 mol => V = 45ml
Vậy : B đúng
H+ + OH- => H2O 1
0,02......0,02
H+ + AlO2 - + H2O => Al(OH)3 2
0,02.....0,02.........................0,02
3H+ + Al(OH)3 => Al3+ +3H2O 3
0,03.........0,01
do cần V lớn nhất nên xét TH tạo kết tủa xong hòa tan 1 phần kết tủa
n Al(OH)3 =0,01 => nAl(OH)3 ở 3 =0,01
=> nHCl= 0,03 +0,02 +0,02 =0,07 => V=0,035 => C

Coi như hỗn hợp X chỉ gồm Na, K, Ba, O
Cho X vào nước thì 3 kim loại phản ứng sinh ra khí H2, còn O tác dụng với H2 để tạo ra nước theo tỷ lệ 1Oxi+1H2
\(\Rightarrow\) \(n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_O=0,14\left(mol\right)\)
Có \(n_{Na}=n_{NaOH}=0,18\left(mol\right)\)
\(n_K=n_{KOH}=\frac{0,044m}{56};n_{Ba}=n_{Ba\left(OH\right)_2}=\frac{0,93m}{171}\left(mol\right)\)
\(\Rightarrow n_O=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_{H_2}=0,09+\frac{0,022m}{56}+\frac{0,465m}{171}\)
Lại có phương trình tổng khối lượng hỗn hợp X:
\(m_X=m=m_{Na}+m_K+m_{Ba}+m_O\\ =0,18.23+\frac{0,044m}{56}.39+\frac{0,93m}{171}.137+m_O\)
Thay số mol Oxi tính được (theo m) ở trên vào ta được phương trình 1 ẩn m
giải ra được \(m\approx25,5\)

a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.
a) (mol).
=> = 0,464M.
b) Fe + CuSO4 -> FeSO4 + Cu
0,232 (mol).
=> mFe = 0,232.56 = 12,992 gam.

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Fe3O4 + 4H2SO4 → Fe2(SO4)3 + FeSO4 + 4H2O; Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,02 0,02 0,02 x x 2x
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
0,05 0,01
2x + 0,02 = 0,05 → x = 0,015 mol


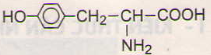 với các chất sau:
với các chất sau: