Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left(1\right)FeSO_4+Mg\) \(\rightarrow\) \(MgSO_4+Fe\)
\(\left(2\right)3Fe+2O_2\)\(\rightarrow\) \(Fe_3O_4\)
\(\left(3\right)Fe_3O_4+4H_2\)\(\rightarrow\)\(3Fe+4H_2O\)
\(\left(4\right)2Fe+3Cl_2\)\(\rightarrow\)\(2FeCl_3\)
3FeSO4 + 2Al \(\rightarrow\) Al2(SO4)3 + 3Fe
3Fe + 2O2 \(\underrightarrow{to}\) Fe3O4
Fe3O4 + 4CO \(\underrightarrow{to}\) 3Fe + 4CO2
2Fe + 3Cl2 \(\rightarrow\) 2FeCl3

Fe2(SO4)3 + 3BaCl2 → 2FeCl3 + 3BaSO4
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3
2Fe(OH)3 ---to---> Fe2O3 + 3H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O

a(1),fe+2hcl->fecl2+h2 (2) fecl2+ba(oh)2->fe(oh)2+bacl2 (3)fe(oh)2+h2so4->feso4+2h20 (4)feso4+bacl2->fecl2+baso4
b.(1)2fe+3cl2->2fecl3 (2)2fecl3+3ba(oh)2->2fe(oh)3+3bacl2 (3)2fe(oh)3+o2->fe2o3+h2o (4)fe2o3+3co->2fe+3co2

Cho hỗn hợp ở trên cho tác dụng với NaOH dư
Al2O3+2NaOH----->2NaAlO2+H2O
SiO2+2NaOH---->Na2SiO3+H2O
Lọc kết tủa ta thu được Fe2O3 không tan
Vậy ta đã tách được Fe2O3 ra khỏi hỗn hợp
MO+2HCl----->MCl2+H2O
mHCl=10.21,9/100=2,19 g
nHCl=2,19/36,5=0,06 mol
cứ 1 mol MO-----> 2 mol Hcl
0,03 mol<-------0,06 mol
Phân tử khối của Mo là 2,4/0,3=80
M+16=80
----->M=64 ---->CTHH CuO

a/3FexOy + (12x-2y)HNO3 ----->3xFe(NO3)3 + (3x-2y)NO + (6x-y)H2O
b/CxHyOzNt +(x+y4y4-z2z2 )O2 ----> xCO2 + y2y2H2O + t2t2N2
c/mFexOy + (ym-xn)CO t°→ xFemOn + (ym-xn)CO2↑
d/ FexOy + (6x-2y) HNO3 = x Fe(NO3)3 + (3x-2y) NO2+(3x-y) H2O
e/2FexOy+(6x-2y)H2So4-> xFe2(SO4)3 + (3x-2y) SO2+ (6x-2y)H20
| f/5O2 | + | 4FeCu2S2 | → | 8CuO | + | 2Fe2O3 | + | 8SO2 |

a) phân loại :
* oxit axit :
+ CO : cacbon monooxit
+ CO2 : cacbon đioxit ( cacbonic)
+ N2O5: đinito pentaoxit
+NO2: nito đioxit
+ SO3: lưu huỳnh trioxit
+ P2O5: điphotpho pentaoxit
* oxit bazo ::
+ FeO : sắt (II) oxit
+BaO : bari oxit
+Al2O3: nhôm oxit
+ Fe3O4: oxit sắt từ
b) những chất phản ứng được với nước là
+ CO2
pt : CO2 + H2O -> H2CO3
+N2O5
Pt : N2O5 + H2O -> 2HNO3
+ NO2
pt: NO2 + H2O -> HNO3
+ SO3
Pt : SO3 + H2O -> H2SO4
+ P2O5
pt : P2O5 + 3H2O -> 2H3PO4
+ BaO
pt : BaO + H2O -> Ba(OH)2

1: a/(1) CaO + H2O ->Ca(OH)2
(2) Ca(OH)2+2NaCl->CaCl2 + 2NaOH
(3) CaCl2 + H2SO4 -> CaSO4 + 2HCl
(4) CaSO4 + 2NaOH -> Ca(OH)2 + Na2SO4
(5) 3Ca(OH)2 +2 FeCl3 -> 2Fe(OH)3+ 3CaCl2
1.
a) CaO→(1) Ca(OH)2→(2) CaCl2→(3) CaSO4→(4) Ca(OH)2→(5) Fe(OH)3
(1) CaO + H2O -> Ca(OH)2
(2) Ca(OH)2 + CuCl2 -> CaCl2 + Cu(OH)2
(3) CaCl2 + H2SO4 -> CaSO4 + 2HCl
(4) CaSO4 + Ba(OH)2 -> BaSO4 + Ca(OH)2
(5) 3Ca(OH)2 + 2FeCl3 -> 2Fe(OH)3 + 3CaCl2
b) NaAlO2→(1) Al(OH)3→(2)Al2O3→(3)Al→(4) Al2(SO4)3
(1) NaAlO2 + HCl +H2O -> NaCl + Al(OH)3
(2) 2Al(OH)3 (nhiệt phân) --> Al2O3 + 3H2O
(3) Al2O3 + 3CO -> 2Al + 3CO2
(4)2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
2 Bằng phương pháp hóa học hãy nhận biết các chất sau:
Mình làm ngắn gọn bạn tự trình bày và viết PTHH nha
a) BaO, CaO, Fe2O3
=> Cho vào nước
+ Qt hóa xanh : CaO , BaO
+ K có ht gì : Fe2O3
Cho CaO và BaO vào dd H2SO4 => Xuất hiện kết tủa trắng => Đó là BaO còn lại CaO
b) KOH, HCl, BaCl2, Na2SO4
=> + Qtim hoa xanh : KOH
+ Hóa đỏ : HCl
+ K có htuong gì : BaCl2 , Na2SO4 (1)
- Cho dd H2SO4 và (1) => xuát hiện kết tủa => BaCl2 , còn lại Na2SO4
PTHH bạn tự viết nha

a)
CuO + 2HCl ---> CuCl2 + H2O
Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O
b)
nHCl= 3.5 x 0.2 = 0.7
Đặt x, y lần lượt là số mọl của HCl ở pt 1, pt2
2HCl + CuO ----> CuCl2 + H2O
2x-------------x-----------x--------- x
6HCl + Fe2O3-----> 2FeCl3 + 3H2O
6y---------------y----------------2y--... 3y
ta có hệ phương trình hai ẩn x, y
2x+ 6y = 0.7
80x+160y=20
===> x=0.05;y = 0.1
m CuO= 0.05 x 80=4 g
m Fe2O3= 0.1 x 160 =16 g
Số mol HCl = 3,5 . 0,2 = 0,7 mol
Gọi x, y là số mol của CuO và Fe2O3
a) CuO + 2HCl → CuCl2 + H2O
Phản ứng x → 2x x (mol)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Phản ứng: y → 6y 2y (mol)
Theo khối lượng hỗn hợp hai oxit và theo số mol HCl phản ứng, ta lập được hệ phương trình đại số:
80x+160y=20
2x+6y=0,7
Giải phương trình (1) (2) ta được x = 0,05 mol; y = 0,1 mol
b) mCuO = 0,05 . 160 = 4 g
m Fe2O3 = 20 – 4 = 16 g

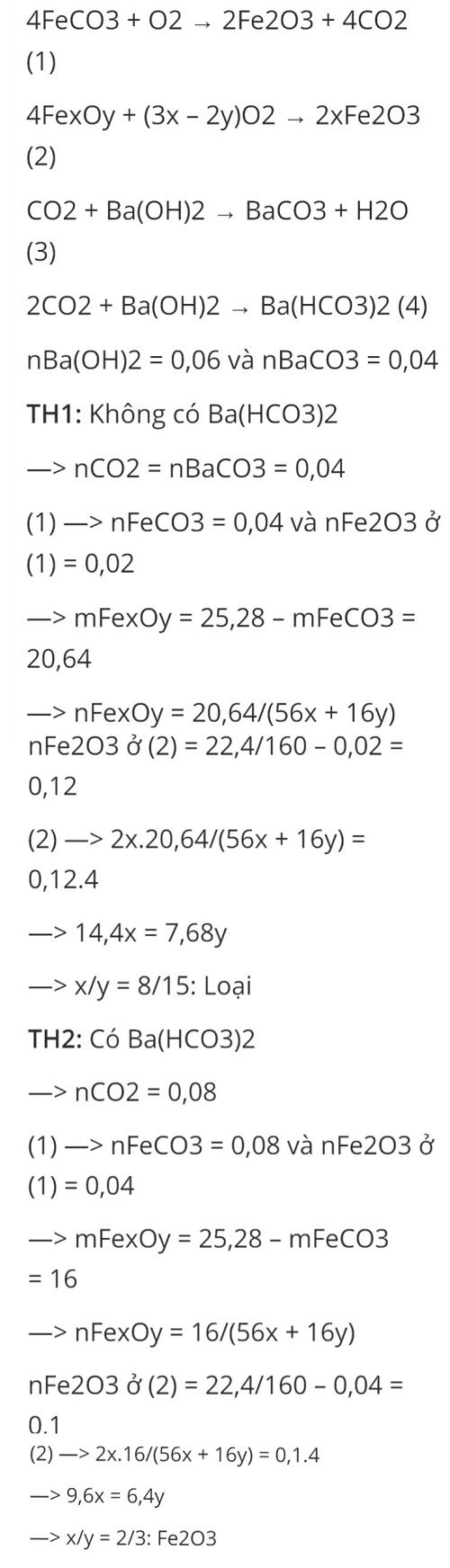
TH1: Từ hóa trị thấp của Fe lên hóa trị cao
Sơ đồ phản ứng: FexOy + O2 \(\underrightarrow{to}\) FemOn
Đặt hệ số của O2 là a
Cân bằng số nguyên tử Fe: \(mFe_xO_y\) → \(xFe_mO_n\)
Số nguyên tử O ở 2 vế: \(my+2a=nx\)
\(\Rightarrow a=\frac{nx-my}{2}\)
Vậy PTHH: mFexOy + \(\frac{nx-my}{2}\)O2 \(\underrightarrow{to}\) xFemOn
TH2: Từ hóa trị cáo của Fe xuống hóa trị thấp
Sơ đồ phản ứng: FexOy + CO \(\underrightarrow{to}\) FemOn + CO2
Đặt hệ số của CO là b
Cân bằng số nguyên tử Fe: \(mFe_xO_y\) → \(xFe_mO_n\)
Cân bằng số nguyên tử C: \(aCO\) → \(aCO_2\)
Số nguyên tử O ở 2 vế: \(my+a=nx+2a\)
\(\Leftrightarrow a=my-nx\)
PTHH: mFexOy + \(\left(my-nx\right)\)CO \(\underrightarrow{to}\) xFemOn + \(\left(my-nx\right)\)CO2
TH1: Từ hóa trị thấp của Fe lên hóa trị cao:
Sơ đồ phản ứng: FexOy + O2 \(\underrightarrow{to}\) FemOn
Đặt hệ số O2 là a
Cân bằng số nguyên tử Fe: mFexOy → xFemOn
Số nguyên tử O ở 2 vế: \(my+2a=nx\)
\(\Rightarrow a=\frac{nx-my}{2}\)
PTHH: mFexOy + \(\frac{nx-my}{2}\)O2 \(\underrightarrow{to}\) xFemOn
TH2: Từ hóa trị cao của Fe xuống hóa trị thấp:
Sơ đồ phản ứng: FexOy + CO \(\underrightarrow{to}\) FemOn + CO2
Đặt hệ số của CO là b
Cân bằng số nguyên tử Fe: mFexOy → xFemOn
Cân bằng số nguyên tử C: bCO → bCO2
Số nguyên tử O ở 2 vế: \(my+b=nx+2b\)
\(\Rightarrow b=my-nx\)
PTHH: mFexOy + \(\left(my-nx\right)\)CO \(\underrightarrow{to}\) xFemOn + \(\left(my-nx\right)\)CO2