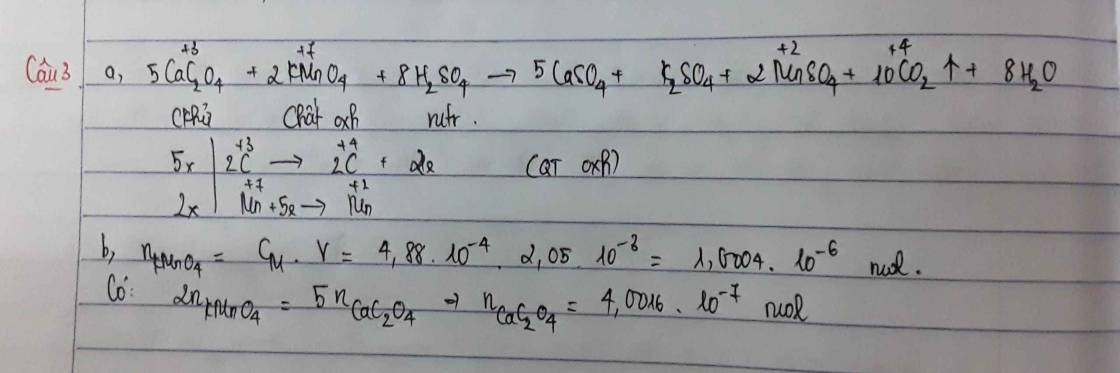Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
1) N2: 0
NH3: N-3
NO: +2
N2O:+1
NO2: +4
HNO3:+5
NH4+: -3
NO3-: N+5
2.
H2S: -2
SO2: +4
SO3:+6
SO32-:+4
H2SO4: +6
HSO4-: S+6
3.
MnO4-:+8
MnO2:+4
MnO42-:+2
MnSO4:+2
4.
Cl2:0
HCl :-1
HClO:+1
KClO3:+5
KClO4:+7

Đề Nguyễn Gia Thiều năm 2017 - 2018
CT là H2O2
3) H2O2 + Ba(OH)2 ⇌ BaO2 + 2H2O
PUHH trên chứng tỏ H2O2 có tính oxi hóa ...

Đối với ion đa nguyên tử, tổng số oxi hóa của các nguyên tố bằng điện tích ion.
Ví dụ NH4+ = (N-3H4+1)+

- NO3-
Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có:
1.x + 3.(-2) = -1 → x = +5.
Vậy số oxi hóa của N là +5, của O là -2.
- NH4+
Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có:
1.x + 4.(+1) = +1 → x = -3.
Vậy số oxi hóa của N là -3, của H là +1.
- MnO4-
Gọi x là số oxi hóa của Mn, theo quy tắc 1 và 2 có:
1.x + 4.(-2) = -1 → x = +7.
Vậy số oxi hóa của Mn là +7, của O là -2

- Ca(OH)2 là 1 hóa chất rẻ tiền, có thể được sản xuất đễ dàng từ nguyên liệu sẵn có là đá vôi (CaCO3).
- Dùng Ca(OH)2 để xử lý sơ bộ khí thải hoặc nước thải vì Ca(OH)2 chuyển hóa khí thành dạng muối, nước thải thành các kết tủa ít độc hại hơn, dễ thu gom, vận chuyển và xử lý hơn.
\(SO_2+Ca\left(OH\right)_2\rightarrow CaSO_3+H_2O\\ SO_3+Ca\left(OH\right)_2\rightarrow CaSO_4+H_2O\\ 4NO_2+2Ca\left(OH\right)_2\rightarrow Ca\left(NO_3\right)_2+2H_2O\\ Fe^{3+}+3OH^-\rightarrow Fe\left(OH\right)_3\\ Cu^{2+}2OH^-\rightarrow Cu\left(OH_2\right)\)
Vì Ca(OH)2 có giá thành rẻ, có thể được sản xuất dễ dàng từ nguyên liệu sẵn có là đá vôi (CaCO3).
Bản chất của cách xử lí này là dùng Ca(OH)2 hấp thụ các khí thải (SO2, NO2,...) cũng như các ion kim loại nặng (Fe3+, Cu2+,...) chuyển hóa thành dạng muối hoặc các kết tủa ít độc hại hơn, dễ dàng thu gom, vận chuyển và xử lí hơn.
Một số phương trình hóa học minh họa:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Fe3+ + 3OH- → Fe(OH)3↓