
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



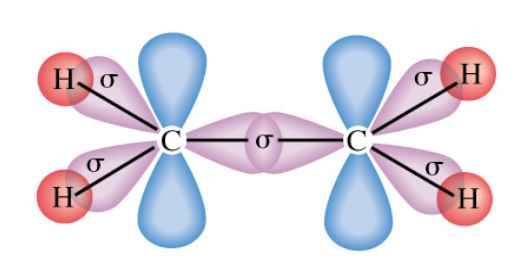
Bước 1: Viết cấu hình electron và ô orbital của lớp electron ngoài cùng cho nguyên tử H, F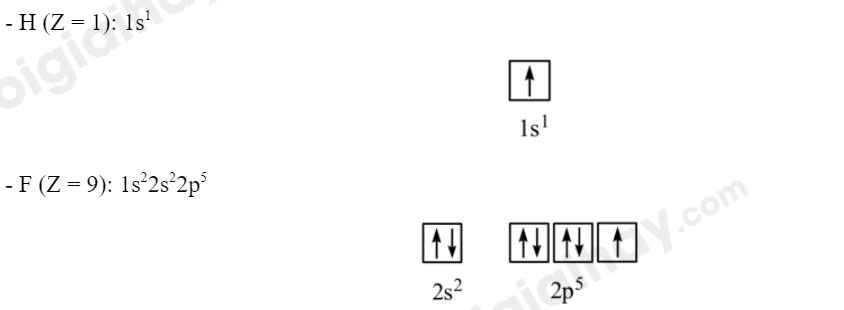
Bước 2: Chỉ ra các AO có thể xen phủ tạo liên kết đơn trong các phân tử H2, F2, HF.
- Trong phân tử H2: 2 AO s xen phủ trục tạo liên kết đơn.
- Trong phân tử F2: 2 AO p xen phủ trục tạo liên kết đơn.
- Trong phân tử HF: 1 AO s của H và 1 AO p của F xen phủ trục tạo liên kết đơn

a)
Liên kết hydrogen được hình thành dựa trên hai điều kiện:
- Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N,…
- Nguyên tử F, O, N…. liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
Phân tử có thể tạo liên kết hydrogen là CH3OH, NH3 do O và N còn cặp electron hóa trị chưa tham gia liên kết.
b)
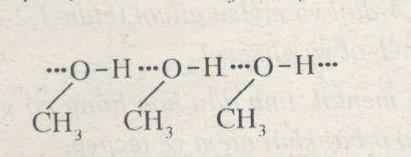
Liên kết hydrogen giữa các phân tử CH3OH

Liên kết hydrogen giữa các phân tử NH3

Na2O, MgO, Al2O3
SiO2, P2O5, SO3
Cl2O7
∆X
2,51 2,13 1,83
( Liên kết ion )
1,54 1,25 0,86
( Liên kết cộng hóa trị có cực)
0,28
(Liên kết cộng hóa trị không cực)

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
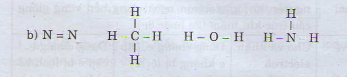
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

ta xét sự chênh lệch về độ âm điện nếu khoảng chênh lệch x 0,4<x<1,7 thì hợp chất đã cho là hợp chất có lk cộng hóa trị có cực
Có độ âm điện của Na,S,O,Cl,F lần lượt là 0,9;2,5;3,5;3;4
Na2S x1=2,5-0,9=1,6 tm
Na2O x2=3,5-0,9=2,6 loại
NaCl x3=3-0,9=2,1 loại
NaF x4=4-0,9=3,1 loai
Vậy chỉ có Na2S tm chọn A