Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bạn hs đã kết luận sai
a) vì nếu trong lọ đều chứa NaOH thì khi mở nắp lâu ngày có khí So2, Co2 tác dụng vs NaOH
NaOH+CO2->NaHCO3
NaOH+SO2->NaHSO3
NaHSO3+HCl-> NaCl+H2O+CO2
b) NaHSO4, NaNO3

Đồng kim loại sẽ tạo nên một số ion Cu2+ tan vào trong nước sẽ có tác dụng diệt khuẩn . Làm cho các cuống hoa đỡ bị thối trong nước do đó đỡ làm tắc các mao quản dẫn nước lên cánh hoa nên hoa tươi hơn. Các muối của Cu2+ có tính diệt khuẩn rất tốt người ta thường dùng CuSO4 để sát khuẩn trong bể bơi. Nếu không dùng đoạn dây đồng thì nên cắt bỏ phần thối mỗi ngày, hoa mới tuơi lâu
Để giải bài tập này, học sinh cần nắm được tính tan của một chất nói chung, khi ta nói rằng một chất không tan trong nước thì ý để chỉ rằng độ tan của nó trong nước là rất nhỏ, tuy vậy đôi khi có những chất ở nồng độ rất nhỏ cũng đã thể hiện những tính chất quan trọng. Ngoải ra học sinh còn phải nắm được tác dụng diệt khuẩn của ion Ag+ và Cu2+

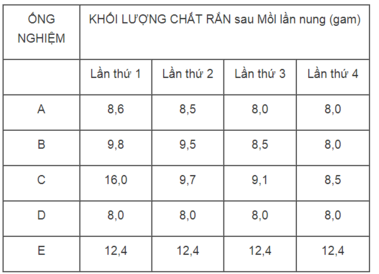
1. Ống nghiệm E (khối lượng CuCO 3 không thay đổi).
2. Ống nghiệm C, vì khác với các kết quả của những ống nghiệm A, B, D.
3. Sau lần nụng thứ 3 thì toàn lượng CuCO 3 đã bị phân huỷ hết thành CuO.
4. Ống nghiệm D.

Do cấu tạo tinh thể iot là phân tử không phân cực nên giữa các phân tử iot chỉ có lực tương tác phân tử là lực vander wan, lực này rấtt yếu nên chỉ cần 1 năng lượng nhỏ là liên kết giũa các phân tử bị phá hủy rất nhanh
=> chuyển thẳng từ thể rắn sang thể khí (thăng hoa)

Cái ý thức để hoài trong c ứ t thì lâu ngày cũng thối như nó mà thôi :)
Trả lời:
-Trong mật ong có đường Glucose ,khi gặp môi trường thích hợp (nắp bình kín lâu ngày tạo môi trường yếm khí) thì các vi sinh vật bắt đầu chuyển hóa đường Glucose có trong mật ong, trong quá trình này một lượng khí CO2 sẽ dần được sinh ra.
-Khi bạn mở nắp bình, áp suất bên ngoài thấp nên CO2 lập tức bay vào không khí. Vì vậy các bọt khí thoát ra giống như lúc ta đun nước sôi
:))