Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

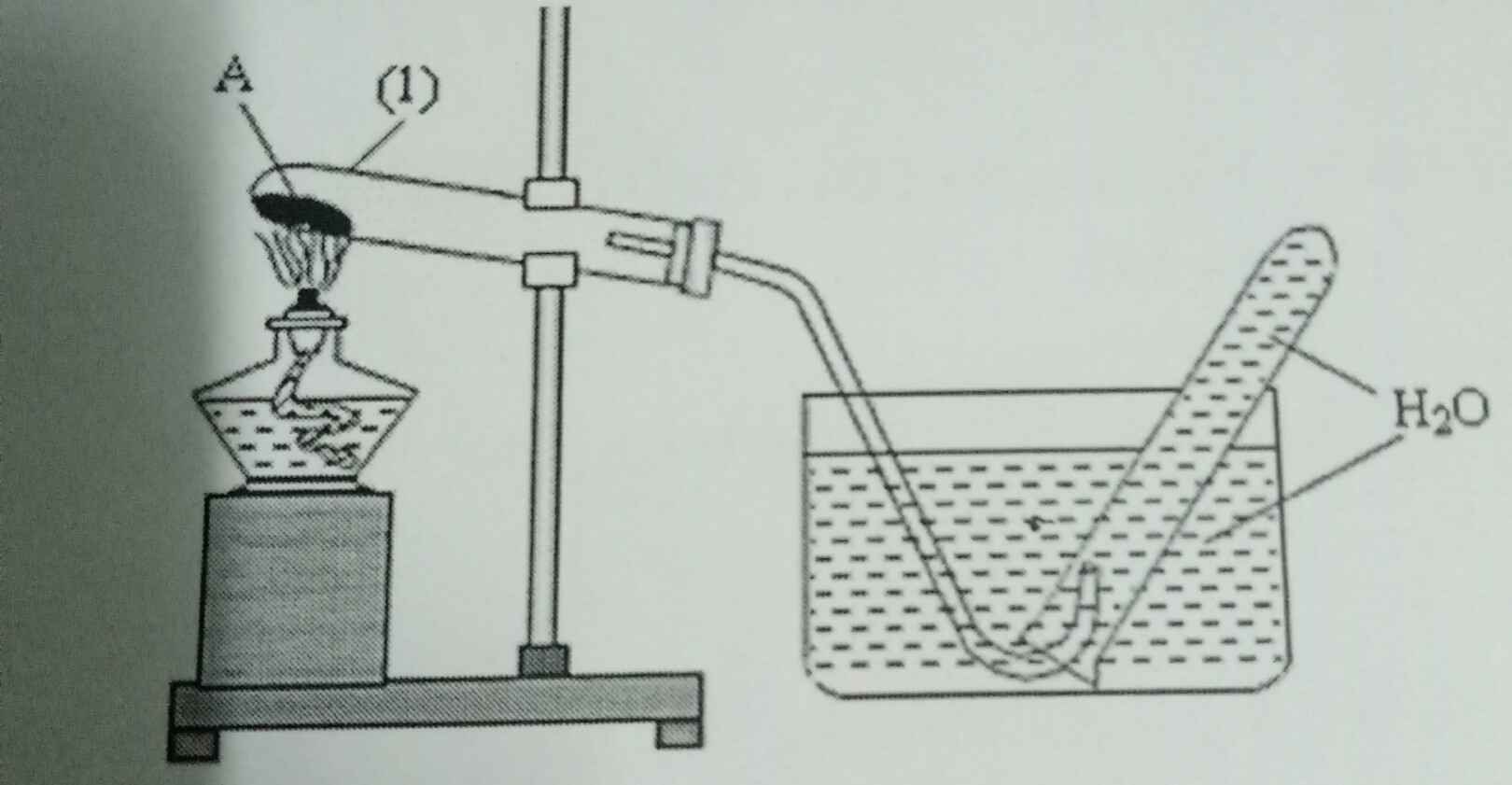
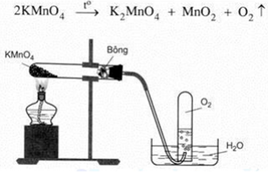
– Dùng phương pháp đẩy nước là hợp lí vì oxi ít tan trong nước và oxi thu được có độ tinh khiết cao.
– Oxi nặng hơn không khí, khi đốt nóng KMnO4 thì áp suất tại đó cao hơn nên
– Oxi sinh ra sẽ di chuyển xuống phía dưới ống nơi áp suất thấp hơn và dễ dàng thoát ra ống dẫn khí. – Bông khô có vai trò hút ẩm.
– Khi dừng thí nghiệm nên tắt đèn cồn trước sau đó mới tháo ống dẫn khí.

X: Fe3O4
Y: FeCl2
Z: FeCl3
T: Fe(OH)2
U: Fe(OH)3
A: NaCl (hoặc H2O)
B: H2O (hoặc NaCl)
D: H2 (hoặc Cl2)
E: Cl2 (hoặc H2)
F: NaOH
G: HCl
PTHH:
a) NaCl + H2O -dpmn----> 1/2 H2 + 1/2 Cl2 + NaOH
H2 + Cl2 -to-> 2 HCl
HCl + NaOH -> NaCl + H2O
b) 3 Fe +2 O2 -to->Fe3O4
Fe3O4 + 8 HCl -> FeCl2 +2 FeCl3 + H2O
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
FeCl3 +3 NaOH -> Fe(OH)3 + 3NaCl
Chúc em học tốt!

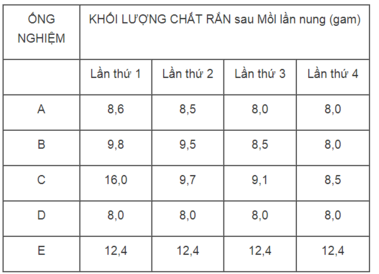
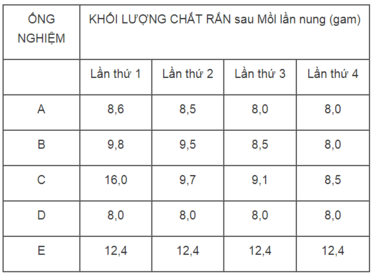
1. Ống nghiệm E (khối lượng CuCO 3 không thay đổi).
2. Ống nghiệm C, vì khác với các kết quả của những ống nghiệm A, B, D.
3. Sau lần nụng thứ 3 thì toàn lượng CuCO 3 đã bị phân huỷ hết thành CuO.
4. Ống nghiệm D.

Các hàng lỗ đục ở ống sắt hình trụ có tác dụng hút không khí ở ngoài vào, hoà trộn đểu với hơi dầu bốc lên tạo ra hỗn hợp hơi và dầu. Khi đó hơi dầu cháy gần như hoàn toàn và không có muội than.

Phần tính toán :
Theo phương trình hoá học :
124 gam CuCO 3 sau khi bị phân huỷ sinh ra 80 gam CuO.
Vậy 12,4 gam CuCO 3 sau khi bị phân huỷ sinh ra :
m CuO = 80x12,4/124 = 8g
Thí nghiệm được tiến hành trong các ống nghiệm A, B, D là đúng.

Cả ba ống natri đều tan, tạo bọt khí không màu không mùi.
Ống 1 :
\(C_2H_5OH + Na \to C_2H_5ONa + \dfrac{1}{2}H_2\)
Ống 2 : đựng rượu 90o (tức là hỗn hợp đồng nhất giữa nước và etanol).
\(C_2H_5OH + Na \to C_2H_5ONa + \dfrac{1}{2}H_2\\ Na + H_2O \to NaOH + \dfrac{1}{2}H_2\)
Ống 3 :
\(H_2O + Na \to NaOH + \dfrac{1}{2}H_2\)

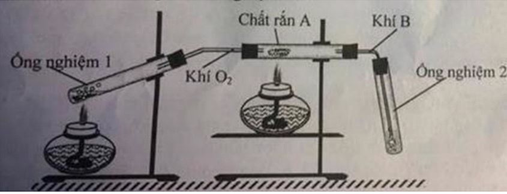
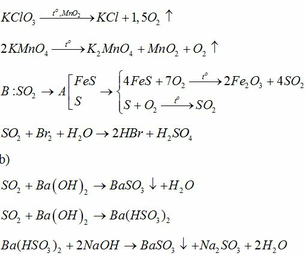
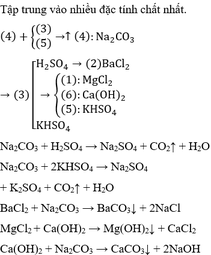

2 lí do :
- Có thể khí sinh ra nặng hơn không khí, đặt như vậy giúp khí dễ thoát ra ngoài
- Hơi nước sinh ra khi đốt ống nghiệm thoát ra ngoài, tránh gây nổ ống nghiệm