Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Tinh thể ion: Nacl; MgO; CsBr; CsCl
Tinh thể nguyên tử: Kim cương
Tinh thể phân tử: Băng phiến, iot, nước đá, cacbon đioxit
b) So sánh nhiệt độ nóng chảy:
Lực hút tĩnh điện giữa các ion ngược dấu lớn nên tinh thể ion rất bền vững. Các hợp chất ion đều khá rắn,khó bay hơi,khó nóng chảy
– Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn, vì vậy tinh thể nguyen tử đều bền vững, khá cững, khó nóng chảy, khó bay hơi.
– Trong tinh thể phân tử các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vây tinh thể phân tử dễ nóng chảy, dễ bay hơi
c) Không có tinh thể nào có thể dẫn điện ở trạng thái rắn.
Tinh thể dẫn điện được nóng chảy và khi hòa tan trong nước là: tinh thể ion

Lưu huỳnh tác dụng với axit sunfuric đặc nóng :
S + H2SO4 -> 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số lưu huỳnh bị oxi hóa là
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.

a) Chất có mạng tinh thể nguyên tử: kim cương.
Chất có mạng tinh thể phân tử:ở nhiệt độ thấp thì có khí hiếm, O2, N2,… kết tinh thành tinh thể phân tử.
b) Lực liên kết cộng hóa trị trong tinh thể nguyên tử rất lớn. Vì vậy, tinh thể nguyên tử đều bền vững, khá cứng, khó nóng chảy, khó bay hơi.
Trong tinh thể phân tử, các phân tử hút nhau bằng lực tương tác yếu giữa các phân tử. Vì vậy mà tinh thể phân tử dễ nóng chảy, dễ bay hơi.

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = CM(MnCl2)CM(MnCl2) = CM(NaClO) =0,80,50,80,5 = 1,6 mol/l
CM(NaOH)dư = 2.1,60,52.1,60,5 = 0,8 mol/l

Câu 1 :
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x______2x______x________x__(mol)
\(Al+2HCl\rightarrow AlCl_3+\frac{3}{2}H_2\)
y_____2y______y______3/2y__(mol)
\(n_{khí}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(\left\{{}\begin{matrix}24x+27y=10,2\\x+\frac{3}{2}y=0,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
\(\%m_{Mg}=\frac{10,2-\left(24.0,2\right)}{0,2}.100\%=52,94\%\)
\(\%m_{Al}=100\%-52,94\%=47,06\%\)
\(m_{muoi}=95.0,2+133,5.0,2=28,6\left(g\right)\)
\(V_{HCl}=1,6\left(l\right)\)
Dùng 7,5% \(\Rightarrow V=1,6-1,6.7,5\%=1,48\left(l\right)\)
Câu 2:
\(FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\)
\(n_{FeCl2}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow n_{AgCl}=2n_{FeCl2}=2.0,2=0,4\left(mol\right)\)
\(m_{AgCl}=0,4.143,5=57,4\left(g\right)\)
\(n_{Fe\left(NO3\right)2}=n_{FeCl2}=0,2\left(mol\right)\)
V dd sau phản ứng= VFeCl2 + VAgNO3 = 0,2+0,3= 0,5 (l)
\(\Rightarrow CM_{FeCl2}=\frac{0,2}{0,5}=0,4M\)
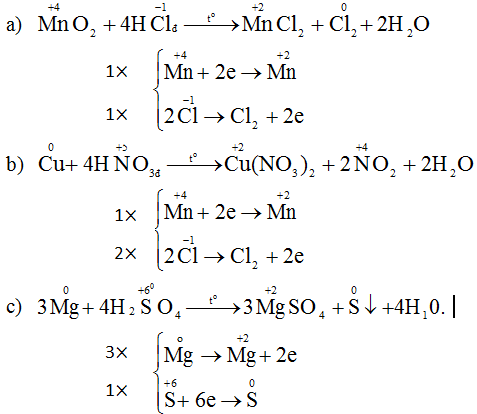
Chọn đáp án A
Trong phòng thí nghiệm, hiđro clorua được điều chế bằng cách cho NaCl tinh thể tác dụng với H 2 S O 4 đặc, đun nóng.