Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Bán kính quỹ đạo tỉ lệ với bình phương của số quỹ đạo
Ở mức năng lượng K; L; M, N, O, P thì có n tương ứng là: 1; 2; 3; 4; 5; 6
Công thức tính bán kính của của các quỹ đạo tương ứng: ![]() .
.
Bán kính tăng 4 lần chỉ có:
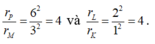
Vậy có 2 khả năng kích thích electron tăng bán kính quỹ đạo lên 4 lần

Đáp án D
*Động năng còn lại của electron:
![]()
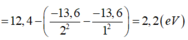
Chú ý: Trạng thái kích thích thứ nhất ứng với n = 2.

Đáp án A
Khi electron chuyển động quanh hạt nhân thì lực điện đóng vai trò là lực hướng tâm nên:
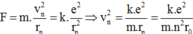
Khi electron chuyển từ quỹ đạo n về quỹ đạo m thì:
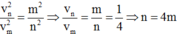
=> Electron chuyển từ quỹ đạo N (n=4) về quỹ đạo K (m=1).

Đáp án A
Khi electron chuyển động quanh hạt nhân thì lực điện đóng vai trò là lực hướng tâm nên:
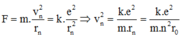
Khi electron chuyển từ quỹ đạo n về quỹ đạo m thì:
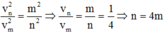
Þ Electron chuyển từ quỹ đạo N (n=4) về quỹ đạo K (m=1)

Đáp án C
Chỉ có 3 vạch nhìn thấy → 3 vạch ở dãy Ban – me ứng với e chuyển từ mức 3 về 2, từ mức 4 về 2 và từ mức 5 về 2. Vậy phải kích thích nguyên tử Hidro đến mức năng lượng ứng với quỹ đạo nào O của electron

Đáp án A
Điện tử chuyển từ mức trên xuống mức K thì các photon phát ra đều thuộc vùng tử ngoại, xuống mức L thì 1 số vạch nằm trong vùng tử ngoại và một số vạch nằm trong vùng nhìn thấy, khi chuyển xuống mức M thì photon phát ra thuộc vùng hồng ngoại.
→ Để phát ra 2 vạch trong vùng nhìn thấy (chuyển xuống mức L) thì phải kích thích nguyên tử đến mức N.

+ Tốc độ của electron khi nó chuyển động trên quỹ đạo n: v n ~ 1 n
→ Khi electron chuyển động từ quỹ đạo K lên quỹ đạo N thì v N = v 4
Đáp án D

Đáp án D
Tốc độ góc ω = v/r.
Trong chuyển động của e quanh hạt nhân thì lực tương tác điện giữa hạt nhân và e đóng vai trò là lực hướng tâm.
Mà
→ Trong các mức năng lượng từ K đến P sẽ có 3 khả năng làm giảm tốc độ góc của electron 8 lần (tức tăng bán kính quỹ đạo 2 lần) đó là:
- Electron từ quỹ đạo K (n = 1) chuyển lên quỹ đạo L (n = 2)
- Electron từ quỹ đạo L (n = 2) chuyển lên quỹ đạo N (n = 4)
- Electron từ quỹ đạo M (n = 3) chuyển lên quỹ đạo P (n = 6).