Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có
Trạng thái 1: { V 1 p 1 = 1 , 5 a t m T 1 = 27 + 273 = 300 K Trạng thái 2: { V 2 = V 1 2 p 2 = ? T 2 = 273 + 127 = 400 K
Áp dụng
p 1 V 1 T 1 p 2 V 2 T 2 ⇒ p 2 = p 1 V 1 T 2 T 1 V 2 = 1 , 5. V 1 .400 300.0 , 5. V 1 p 2 = 4 ( a t m )

Đáp án: A
Ta có:
- Trạng thái 1: T 1 = 27 + 273 = 300 K p 1 = 1 a t m V 1 = n V = 1000.4 = 4000 l
- Trạng thái 2: T 2 = 42 + 273 = 315 K p 2 = ? V 2 = 2 m 3 = 2000 l
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 = p 1 V 1 T 2 T 1 V 2 = 1.4000.315 300.2000 = 2,1 a t m

Đáp ánB
Ký hiệu 1 và 2 lần lượt là chỉ số trạng thái của khí trước và sau khi mở bình
Ta có:
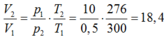
![]()
Thể tích nước: ![]()

Gọi n là số mol khí cacbonic chứa trong bình: n = m/ μ , trong đó M là khối lượng khí cacbonic có trong bình, μ là khối lượng mol của khí cacbonic.
Ta có n = 100 mol
Nếu gọi V 0 là thể tích của lượng khí cacbonic ở điều kiện chuẩn ( p 0 = 1,013. 10 5 Pa; T 0 = 273 K) thì V 0 = n v 0
Áp dụng phương trình trạng thái của khí lí tưởng cho lượng khí cacbonic:
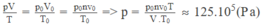

Đáp án C
Trạng thái 1: V1 = ? ; p1 =l atm;
Trạng thái 2: V2 = 201 ; p2 = 25 atm.
Vì quá trình là đẳng nhiệt, nên ta áp dụng định luật Boyle- Mariotte cho hai trạng thái khí (1) và (2):
p1.V1 = p2.V2 ⇒ 1.V1 = 25.20 => V1 = 500 lít

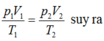
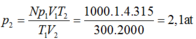


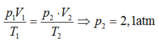
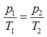
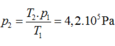
Áp dụng phương trình Menđêlêep- Clapêron
P V = m μ H 2 R T với μ H 2 = 2 g / m o l , T = 300 0 K