Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

ban đầu nN2+ nH2=500 và nN2/nH2=1/4
=>nN2=100 mol và nH2=400 mol
N2 + 3H2 ---> 2NH3
ban đầu 100 400 0
phản ứng x 3x 2x
sau phản ứng (100-x ) ( 400-3x) 2x
lại có 50=2x=> x=25 => H%=( 25/100). 100%=25%.

Ta có MX = 3,6.2 =7,2.
Áp dụng qui tắc đường chéo :
=> nH2 : nN2 = 4 : 1
Đặt nH2 = 4 mol => nN2 = 1 mol
N2 + 3H2 ---> 2NH3
x----->3x-------->2x
=> nY = 5 – 2x mol
Bảo toàn khối lượng :
mX = mY = 4.2 + 1.28 = 36g
=> MY = 4.2 = \(\dfrac{36}{5-2x}\)
=> x = 0,25 mol
Tính hiệu suất theo N2 => H = \(\dfrac{0,25}{1}\)= 25%

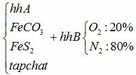
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
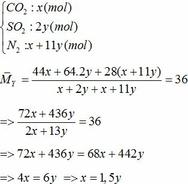
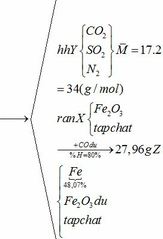
Khối lượng Fe có trong Z là:
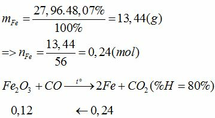
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
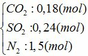
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
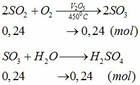
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
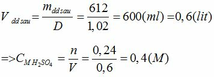

(a) Phản ứng nổ của TNT: 2C7H5N3O6 → 3N2 + 5H2O + 7CO + 7C
(b) 100 gam thuốc nổ Hexanit có chứa 60 gam TNT và 40 gam HND.
Số mol của từng chất là:
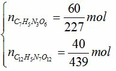
Áp dụng định luật bảo toàn nguyên tố ta có:
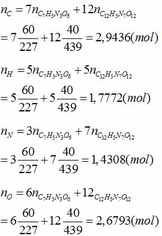
- Phần trăm khối lượng mỗi nguyên tố trong Hexanit:
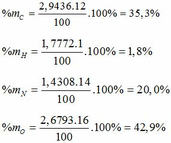
- Sản phẩm nổ của Hexanit là N2, H2O, CO, C
- Áp dụng định luật bảo toàn nguyên tố ta tính được số mol của các chất trong hỗn hợp sau khi nổ:
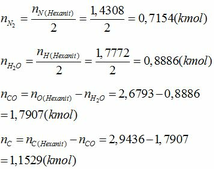
Phần trăm số mol của các chất trong hỗn hợp sau khi nổ:
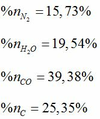


Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
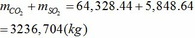
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác

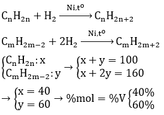
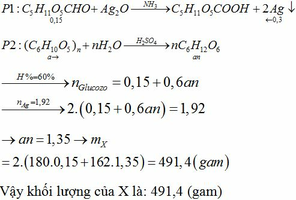
1) N2 + 3H2 ------> 2NH3
x -------> 3x -----------> 2x
theo tỉ lệ đề bài chon n(N2) = 1 mol và n(H2) = 3 mol
gọi x là số mol N2 tham gia pứ
ta có pt đại số theo tỉ khối là:
M(A)/MB) = 0,6 <=> (m/4)/(1 - x + 3 - 3x + 2x) = 0,6 (m: khối lượng của hỗn hợp)
=> x = 0,8
H% = 0,8/1 *100 = 80%
2) ( Bạn đã cho thiếu đề rồi. Bây giờ tôi sẽ thêm vào 10 lit H2)
N2 + 3H2 ------> 2NH3
ban đầu nN2+ nH2=500 và nN2/nH2=1/4
=>nN2=100 mol và nH2=400 mol
N2 + 3H2 ---> 2NH3
ban đầu 100 400 0
phản ứng x 3x 2x
sau phản ứng (100-x ) ( 400-3x) 2x
lại có 50=2x=> x=25 => H%=( 25/100). 100%=25%.