Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`#3107.101107`
a. Sửa đề: Hãy cho biết khối lượng nguyên tử của mỗi nguyên tố có trong phân tử đó.
- Trong phân tử \(\text{SO}_2\) gồm 2 nguyên tử, nguyên tử S và O
`=>` NTK của S là `32` amu, NTK của phân tử O là `16` amu
b.
Khối lượng phân tử của SO2 là:
\(32+16\cdot2=64\left(\text{amu}\right)\)
c.
Số `%` của S có trong SO2 là:
\(\text{%S }=\dfrac{32\cdot100}{64}=50\left(\%\right)\)
Số `%` của O2 có trong SO2 là:
\(\text{%O = 100%}-\text{50% = 50%}\)
Vậy:
a. S: `32` amu, O: `16` amu
b. PTK của SO2 là `64` amu
c. \(\text{%S = 50%; %O = 50%.}\)

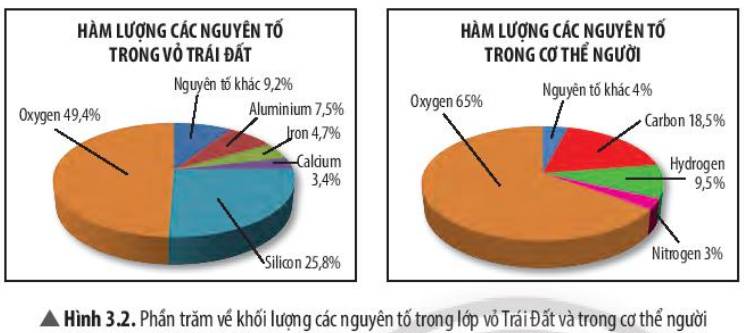
a) Nguyên tố oxygen chiếm hàm lượng cao nhất trong vỏ Trái Đất (chiếm 49,4%)
b) Nguyên tố oxygen chiếm tỉ lệ phần trăm lớn nhất trong cơ thể người. ( chiếm 65%)

1. Lập công thức khi biết hóa trị
Giả sử hợp chất gồm 2 nguyên tố A và B, có hóa trị lần lượt là \(x\) và \(y\).
- Quy tắc: Tích chéo hóa trị → chỉ số nguyên tử.
\(A_{x} B_{y} \rightarrow A_{y} B_{x}\)
📌 Ví dụ: Lập công thức của hợp chất giữa Al (III) và O (II):
\(A l^{3 +} , \&\text{nbsp}; O^{2 -} \Rightarrow A l_{2} O_{3}\)
2. Lập công thức khi biết thành phần phần trăm khối lượng các nguyên tố
Quy trình:
Bước 1: Giả sử có 100 g hợp chất
→ số gam mỗi nguyên tố chính bằng phần trăm của nó.
Bước 2: Tính số mol từng nguyên tố
\(n = \frac{\text{kh} \overset{ˊ}{\hat{\text{o}}} \text{i}\&\text{nbsp};\text{l}ượ\text{ng}}{\text{nguy} \hat{\text{e}} \text{n}\&\text{nbsp};\text{t}ử\&\text{nbsp};\text{kh} \overset{ˊ}{\hat{\text{o}}} \text{i}}\)
Bước 3: Chia số mol cho giá trị nhỏ nhất
→ được tỉ lệ số nguyên tử gần đúng.
Bước 4: Rút gọn thành số nguyên tối giản
→ đó là công thức đơn giản nhất (công thức nguyên).
Bước 5 (nếu đề cho M – khối lượng mol của hợp chất):
Tính hệ số \(k = \frac{M_{t h ự c}}{M_{đo n g i ả n}}\).
Nhân toàn bộ chỉ số trong công thức đơn giản với \(k\) để ra công thức phân tử.
📌 Ví dụ: Hợp chất X có 40% C, 6,7% H, 53,3% O. Xác định công thức.
- Giả sử 100 g chất → C: 40 g, H: 6,7 g, O: 53,3 g.
- Số mol:
\(n_{C} = \frac{40}{12} \approx 3.33 , n_{H} = \frac{6.7}{1} \approx 6.7 , n_{O} = \frac{53.3}{16} \approx 3.33\) - Chia cho số nhỏ nhất (3.33):
\(C : 1 , \&\text{nbsp}; H : 2 , \&\text{nbsp}; O : 1\)
→ Công thức đơn giản nhất: CH₂O.
- Nếu khối lượng mol thực tế cho là 60 g/mol → khối lượng mol CH₂O = 30 → \(k = 2\).
→ Công thức phân tử: C₂H₄O₂.

\(K.L.P.T_{SO_2}=32+16.2=64< amu>.\)
\(\%S=\dfrac{32.100}{64}=50\%.\)
\(\%O=100\%-50\%=50\%.\)
\(\%H=\dfrac{1.2}{18}.100\%=11,1\%\)
\(\%O=\dfrac{16.1}{18}.100\%=88,8\%\)