Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 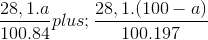 = 0,2
= 0,2
=> a = 29,89.

Số mol H3PO4: 0,050 x 0,50 = 0,025 (mol).
H3PO4 + 3NaOH → Na3PO4 + 3H2O
1 mol 3 mol
0,025 mol 3 x 0,025 mol
Thể tích dung dịch NaOH: 0,075 lít hay 75 ml

bạn có ghi bài trên lớp phần cấu tạo chất đủ không. co mình mượn chép lại mấy bài phần đó với

Các cặp chất là đổng đẳng của nhau : C3H7OH và C4H9OH;
CH3 - О - C2H5 và C2H3 - О - C2H5
Các cặp chất là đồng phân của nhau : CH3-O-C2H5 và C3H7OH;
C2H5-O-C2H5 và C4H9OH.

- Từ dung dịch AgNO3 có 3 cách để điều chế Ag:
+ Dùng kim loại có tính khử mạnh hơn để khử ion Ag+.
Cu + 2 AgNO3 → Cu(NO3)2 + 2Ag
+ Điện phân dung dịch AgNO3:
4AgNO3 + 2H2O 4Ag + O2 + 4HNO3
+ Cô cạn dung dịch rồi nhiệt phân AgNO3:
2AgNO3 2Ag + 2NO2 + O2
- Từ dung dịch MgCl2 điều chế Mg: chỉ có một cách là cô cạn dung dịch để lấy MgCl2 khan rồi điện phân nóng chảy:
MgCl2 Mg + Cl2.
\(4AgNO_3+2H_2O\) \(\underrightarrow{dpdd}\) \(4Ag+O_2\uparrow+4HNO_3\)
\(2AgNO_3\) \(\underrightarrow{t^o}\) \(2Ag+2NO_2+O_2\)
\(MgCl_2\) \(\underrightarrow{dpnc}\) \(Mg+Cl_2\)

a) Ta có: Mật độ xác suất tìm thấy electron trong vùng không gian xung quanh hạt nhân nguyên tử:
D(r) = R2(r) . r2
= 416/729 . a0-5 . r2 . (2 - r/3a0)2 . e-2r/3a0 . r2
= 416/729 . a0-5 . (4r4 - 4r5/3a0 + r6/9a02) . e-2r/3a0
Khảo sát hàm số D(r) thuộc r
Xét: d D(r)/ dr = 416/729 . a0-5 . [(16r3 - 20r4/3a0 + 2r5/3a02) . e-2r/3a0 - (4r4 - 4r5/3a0 + r6/9a02) . 2/3a0 . e-2r/3a0 ]
= 416/729 . a0-5 . e-2r/3a0 . r3 . (16a03 - 28r/3a0 + 14r2/9a02 - 2r3/27a03)
= 832/19683 . a0-8 . e-2r/3a0 . r3 . (-r3 +21r2.a0 - 126r.a02 +216a03)
= - 832/19683 . a0-8 . e-2r/3a0 . r3 . (r - 6a0).(r - 3a0).(r - 12a0)
d D(r)/ dr = 0. Suy ra r =0; r =3a0 ; r = 6a0; r = 12a0
Với r = 0 : D(r) =0
r =3a0 : D(r) = 416/9 .a-1 . e-2
r =6a0 : D(r) = 0
r =12a0 : D(r) = 425984/9.a-1 . e-8
b) Ai vẽ câu này rồi cho up lên với, cám ơn mọi người trước nhé!
a)Mật độ xác suất có mặt electron tỷ lệ với |R3P|2.r2
D(r)=|R3P|2.r2 =D (r)=\(\frac{416}{729}\) .a0-5.(2r2- \(\frac{r^3}{3a_0}\)).\(^{e^{-\frac{2r}{3a_0}}}\)
Lấy đạo hàm của D theo r để khảo sát mật độ xác suất :
D' (r)= \(\frac{416}{729}\) .a0-5.2.(2r2-\(\frac{r^3}{3a_0}\)).(4r-\(\frac{r^2}{a_0}\)).\(^{e^{-\frac{2r}{3a_0}}}\)+\(\frac{416}{729}\) .a0-5.(2r2-\(\frac{r^3}{3a_0}\))2.(-\(\frac{2}{3a_0}\)).\(^{e^{-\frac{2r}{3a_0}}}\)
=\(\frac{832}{729}\). a0-6.\(^{e^{-\frac{2r}{3a_0}}}\). (2r2-\(\frac{r^3}{3a_0}\)) .[(4r-\(\frac{r^2}{a_0}\)).a0 -\(\frac{1}{3}\). (2r2-\(\frac{r^3}{3a_0}\))]
=\(\frac{832}{729}\). a0-6.\(^{e^{-\frac{2r}{3a_0}}}\).r3.(2- \(\frac{r}{3a_0}\)).(\(\frac{r^2}{9a_0}-\frac{5r}{3}+4a_0\))
=>D’(r)=0 => r=0 ,r=3a0 ,r=6a0 ,r=12a0.
Với:r=0 =>D(r)=0
r=3a0 =>D(r)=0
r=6a0 =>D(r)=\(\frac{416}{9a_0.e^2}\)
r=12a0=>D(r)=\(\frac{425984}{a_0.e^8}\)
b)

Đáp án C