Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nBa(OH)2 = 0,002 mol; nKOH = 0,006 mol → ∑ n O H - = 0,002.2 + 0,006 = 0,01 mol
→ [OH-] = n V = 0 , 01 0 , 2 + 0 , 2 = 0,025 → pOH = –lg[OH-] = -lg0,025 = 1,6
Mà pH + pOH = 14 → pH = 12,4
Đáp án C

nBa(OH)2 = 0,002 mol; nKOH = 0,006 mol → ∑ n O H - = 0,002.2 + 0,006 = 0,01 mol
→ [OH-] = n V = 0 , 01 0 , 2 + 0 , 2 = 0,025 → pOH = –lg[OH-] = -lg0,025 = 1,6
Mà pH + pOH = 14 → pH = 12,4
Đáp án C

Chọn C
Số mol Ba ( OH ) 2 = 0,2.0,01 = 0,002 mol; Số mol KOH = 0,2.0,03 = 0,006 mol
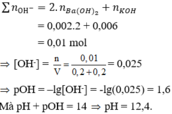

Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

nHCl=0.4x0.15=0.06mol => nH+=0.06mol
nNAOH=0.1x0.1=0.01mol =>nOH=0.01mol
Suy ra nH+ dư=0.06-0.01(phản ứng với OH)=0.05mol
Dung dịch sau phản ứng có [H+]=0.05/0.5=0.1M
pH=1
==>pH=-log(0.1)=1
\(n_{H^+}=0,4.0,15=0,06\left(mol\right);n_{OH^-}=0,1.0,1=0,01\left(mol\right)\)
PT ion rút gọn: \(H^++OH^-\rightarrow H_2O\)
0,01<---0,01
=> \(n_{H^+\left(d\text{ư}\right)}=0,06-0,01=0,05\left(mol\right)\)
=> \(\left[H^+\right]=\dfrac{0,05}{0,5}=0,1M\)
=> \(pH=-\log\left(0,1\right)=1\)
=> x = 1
Hình như đáp án bị sai?
Chọn B