Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Khi cho kẽm vào dung dịch Y, sau khi phản ứng xong thì thấy khối lượng thanh kẽm tăng nên trong Y phải có ion Ag+. Do AgNO3 dư nên đặt


Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

Tăng giảm khối lượng ta có; $n_{NaX}=\frac{2,35-1,5}{108-23}=0,01(mol)$
$\Rightarrow M_{NaX}=150\Rightarrow X=127$
Vậy CTHH của muối là NaI
Bảo toàn nguyên tố X và Ag ta có: $n_{AgNO_3}=n_{AgI}=0,01(mol)\Rightarrow C_{M}=1M$
PTHH: \(NaX+AgNO_3\rightarrow NaNO_3+AgX\downarrow\)
Theo PTHH: \(n_{NaX}=n_{AgX}\)
\(\Rightarrow\dfrac{1,5}{23+X}=\dfrac{2,35}{108+X}\) \(\Leftrightarrow X=127\) (Iot)
\(\Rightarrow\) Công thức: NaI
Ta có: \(n_{AgNO_3}=n_{NaI}=\dfrac{1,5}{150}=0,01\left(mol\right)\)
\(\Rightarrow C_{M_{AgNO_3}}=\dfrac{0,01}{0,01}=1\left(M\right)\)

Chất rắ B là Cu
Fe3O4+8HCl--->2FeCl2+FeCl3+4H2O
FeCl2+2AgNO3--->Fe(NO3)2+2AgCl
FeCl3+3AgNO3--->Fe(NO3))3+3AgCl
n FE3O4=23,2/232=0,1(mol)
n HCl=0,4.2=0,8(mol)
Do 0,1/1=0,8/1--> sau pư ko có dd HCl dư
Theo pthh1
n FECl3=2n Fe3O4=0,2(mol)
Theo pthh3
n AgCl=3n FeCl3=0,6(mol)
Theo pthh1
n FeCl2=n Fe3O4=0,1(mol)
Theo pthh2
n AgCl=2n FeCl2=0,2(mol)
Tổng n AgCl=0,2+0,6=0,8(mol)
m X=m AgCl=143,5.0,8=114,8(g)

Bài 21
Na2CO3 +2HCl---> 2NaCl +H2O +CO2
Theo pthh
n\(_{CO2}=n_{NA2CO3}=0,15\left(mol\right)\)
V=0,15.22,4=3,36(L)
Bài 21
PTHH : Na2CO3+HCl--->NaCl+H2O+CO2
nCO2 = 0,15 mol
VÌ nCO2 = n Na2CO3
=> V = 3,36l
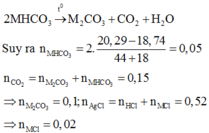

Okay confirm với em đăng đề là a) Tính a và b) Xđ C% các chất trong X
\(m_{ddHCl}=200.1,2=240\left(g\right)\\ m_{HCl}=240.3,65\%=8,76\left(g\right)\\ \Rightarrow n_{HCl}=\dfrac{8,76}{36,5}=0,24\left(mol\right)\\ n_{AgNO_3}=\dfrac{200.3,4\%}{170}=0,04\left(mol\right)\\ PTHH:HCl+AgNO_3\rightarrow AgCl\downarrow+HNO_3\\ Vì:\dfrac{0,04}{1}< \dfrac{0,06}{1}\Rightarrow HCldư\\ \Rightarrow n_{AgCl}=n_{HNO_3}=n_{HCl\left(p.ứ\right)}=n_{AgNO_3}=0,4\left(mol\right)\\ \Rightarrow a=m_{\downarrow}=m_{AgCl}=143,5.0,04=5,74\left(g\right)\\ X:HCl\left(dư\right),HNO_3\\ n_{HCl\left(dư\right)}=0,24-0,04=0,2\left(mol\right)\\ m_{ddX}=m_{ddHCl}+m_{ddAgNO_3}-m_{AgCl}=240+200-5,74=434,26\left(g\right)\)
\(C\%_{ddHCl\left(dư\right)}=\dfrac{36,5.0,2}{434,26}.100\approx1,681\%\\ C\%_{ddHNO_3}=\dfrac{0,04.63}{434,26}.100\approx0,58\%\)
Đề hỏi gì đó em