Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
• 0,01 mol Al2(SO4)3 + V ml NaOH → ↓
Nung ↓ → 0,005 mol Al2O3
→ nAl(OH)3 = 0,005 × 2 = 0,01 mol.
• TH1: NaOH thiếu
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
nNaOH = 3 × nAl(OH)3 = 3 × 0,01 = 0,03 mol → VNaOH = 0,03 : 0,1 = 0,3 lít = 300ml.
• TH2: NaOH dư
Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4(*)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (**)
Theo (*) nNaOH = 0,01 × 6 = 0,06 mol; nAl(OH)3 = 0,02 mol.
Theo (**) nAl(OH)3 phản ứng = 0,02 - 0,01 = 0,01 mol
→ nNaOH = 0,01 mol
→ ∑nNaOH = 0,06 + 0,01 = 0,07 mol
→ VNaOH = 0,07 : 0,1 = 0,7 = 700 ml

nNaOH = 0,032 (mol) => nOH- = 0,032 (mol)
nAl2(SO4)3 = 0,05 (mol) => nAl3+ = 0,1 (mol)
\(Al^{3+}+3OH^-\left(0,032\right)\rightarrow Al\left(OH\right)_3\downarrow\left(\dfrac{0,032}{3}\right)\)
=> m kết tủa = 0,832 (g)

$n_{Ba^{2+}} = 0,1.0,5 = 0,05 < n_{SO_4^{2-}} = 0,1$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,05(mol)$
$m_{BaSO_4} = 0,05.233 = 11,65(gam)$
$n_{OH^-} = 0,1.0,5.2 + 0,1.0,5 = 0,15(mol)$
$n_{H^+} = 0,1.2 = 0,2(mol)$
$H^+ + OH^- \to H_2O$
$n_{H^+\ dư} = 0,2 - 0,15 = 0,05(mol)$
$V_{dd} = 0,1 + 0,1 + 0,1 = 0,3(lít)$
$[H^+] = \dfrac{0,05}{0,3} = \dfrac{1}{6}M$
$pH = -log( \dfrac{1}{6} ) = 0,778$
\(n_{Ba^{2+}}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.5\cdot2+0.1\cdot0.5=0.15\left(mol\right)\)
\(n_{H^+}=2\cdot0.1\cdot1=0.2\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.05.........0.05.............0.05\)
\(SO_4^{2-}dư\)
\(m_{\downarrow}=0.05\cdot233=11.65\left(g\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.15.......0.15\)
\(n_{H^+\left(dư\right)}=0.2-0.15=0.05\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05}{0.1+0.1+0.1}=\dfrac{1}{6}\)
\(pH=-log\left(\dfrac{1}{6}\right)=0.77\)

Đáp án B
nH+ = 0,05 mol; nOH- = 0,07 mol
H+ + OH- → H2O
Ta thấy H+ hết, OH- dư nên nhúng quỳ tím vào Y thì quỳ tím chuyển thành màu xanh.

\(n_{Ca^{2+}}=0.1\cdot0.4=0.04\left(mol\right),n_{Ba^{2+}}=0.1\cdot0.2=0.02\left(mol\right)\)
\(n_{CO_3^{2-}}=0.2\cdot0.3+0.2\cdot0.1=0.08\left(mol\right)\)
\(Ca^{2+}+CO_3^{2-}\rightarrow CaCO_3\)
\(0.04.......0.04.......0.04\)
\(Ba^{2+}+CO_3^{2-}\rightarrow BaCO_3\)
\(0.02.......0.02.......0.02\)
\(m_{\downarrow}=0.04\cdot100+0.02\cdot197=7.94\left(g\right)\)

\(n_{Ba^{2+}}=0.1\cdot0.05=0.005\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.05\cdot2+0.1\cdot0.3=0.04\left(mol\right)\)
\(n_{Fe^{2+}}=0.1\cdot0.2=0.02\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\cdot0.1=0.01\left(mol\right)\)
\(n_{H^+}=0.1\cdot0.1\cdot2=0.02\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.005....0.005..........0.005\)
\(\Rightarrow SO_4^{2-}dư\)
\(OH^-+H^+\rightarrow H_2O\)
\(0.02.......0.02\)
\(Fe^{2+}+2OH^-\rightarrow Fe\left(OH\right)_2\)
\(0.01....0.04-0.02....0.01\)
\(\Rightarrow Fe^{2+}dư\)
\(m\downarrow=0.005\cdot197+0.01\cdot90=2.065\left(g\right)\)

\(n_{NaOH}=0,25.4=1\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=2.0,05=0,1\left(mol\right)\\ PTHH:6NaOH+Al_2\left(SO_4\right)_3\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ Vì:\dfrac{1}{6}>\dfrac{0,1}{1}\\ \Rightarrow NaOHdư\\ \rightarrow n_{Al\left(OH\right)_3}=2.0,1=0,2\left(mol\right)\\ m_{kt}=m_{Al\left(OH\right)_3}=78.0,2=15,6\left(g\right)\)
\(n_{NaOH}=0.25\cdot4=1\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0.05\cdot2=0.1\left(mol\right)\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
Lập tỉ lệ :
\(\dfrac{0.1}{1}< \dfrac{1}{6}\) \(\Rightarrow NaOHdư\)
\(n_{NaOH\left(dư\right)}=1-0.6=0.4\left(mol\right)\)
\(n_{Al\left(OH\right)_3}=0.1\cdot2=0.2\left(mol\right)\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
\(n_{NaOH}>n_{Al\left(OH\right)_3}\)
=> Kết tủa tan hoàn toàn
\(m_{\downarrow}=0\)

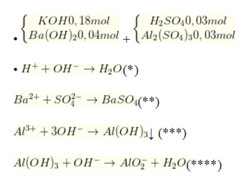
n O H - = n H + = 0 , 06 m o l T h e o ( * * ) n B a S O 4 = n B a 2 + = 0 , 04 m o l T h e o ( * * * ) n O H - = 3 x 0 , 03 x 2 = 0 , 18 m o l ; n A l ( O H ) 3 = 0 , 03 x 2 = 0 , 06 m o l T h e o ( * * * * ) n O H - = 0 , 18 + 0 , 04 x 2 - 0 , 06 - 0 , 18 = 0 , 02 m o l n A l ( O H ) 3 d ư = 0 , 06 - 0 , 02 = 0 , 04 m o l .
→ m↓ = mAl(OH)3 + mBaSO4 = 0,04 × 78 + 0,04 × 233 = 12,44 gam
→ Đáp án đúng là đáp án D

nNaOH=0,3.0,1=0,03mol=nOH-
nKOH=0,1.0,4=0,04mol=nOH-
=>\(\Sigma\)nOH-=0,07mol
nAl2(SO4)3=0,1.0,1=0,01mol
=>nAl3+=2nAl2(SO4)3=0,02mol
Ta thấy: \(\Sigma\)nOH->nAl3+=>OH- dư
Xảy ra 2 phản ứng:
nAl3++3OH-\(\rightarrow\)Al(OH)3\(\downarrow\)
Bđ:0,02--0,07--0
Pư:0,02--0,06--0,02
Spu:0,02--0,01--0,02
=>nOH- dư=0,01mol
Al(OH)3+OH-\(\rightarrow\)[Al(OH)4 ]-(tan)
0,01-------0,01
Kết tủa Al(OH)3 bị hòa tan hết 0,01mol=>nAl(OH)3 còn lại=0,02-0,01=0,01mol
=>mAl(OH)3=0,01.78=0,78g
Biểu thức ΣnOH->nAl3+=>OH- dư nên sửa là ΣnOH->3*nAl3+ nên sau khi tạo kết tủa hoàn toàn thì OH- còn dư. OH- dư sẽ hòa tan Al(OH)3