Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tham khảo :
1. Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
2. Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
3. Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
4. Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
6. Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:

Câu 1 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa đỏ
+ Tác dụng với kim loại :
vd : \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
+ Tác dụng với oxit bazo :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(BaO+H_2SO_4\rightarrow BaSO_4+H_2\)
+ Tác dụng với bazo :
vd : \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(KOH+HCl\rightarrow KCl+H_2O\)
Chúc bạn học tốt
Câu 2 :
+ Làm đổi màu chất chỉ thị màu : làm quỳ tím hóa xanh
+ Tác dụng với oxit axit :
vd : \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
\(2KOH+CO_2\rightarrow K_2CO_3+H_2O\)
+ Tác dụng với axit :
vd : \(NaOH+HCl\rightarrow NaCl+H_2O\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
+ Bazo không tan bị nhiệt phân hủy :
vd : \(Zn\left(OH\right)_2\rightarrow\left(t_o\right)ZnO+H_2O\)
\(2Fe\left(OH\right)_3\rightarrow\left(t_o\right)Fe_2O_3+3H_2O\)
Chúc bạn học tốt

\(1.ZnCO_3+6HCl\rightarrow ZnCl_2+CO_2+H_2O\\ CuCO_3+H_2SO_4\rightarrow CuSO_4+CO_2+H_2O\\ 2.Li_2CO_3+Ca\left(OH\right)_2\rightarrow2LiOH+CaCO_3\\ Li_2CO_3+Ba\left(OH\right)_2\rightarrow2LiOH+BaCO_3\\ 3.KHCO_3+KOH\rightarrow K_2CO_3+H_2O\\ LiHCO_3+LiOH\rightarrow Li_2CO_3+H_2O\\ 4.2LiHCO_3+2KOH\rightarrow Li_2CO_3+K_2CO_3+2H_2O\\ 2KHCO_3+2LiOH\rightarrow Li_2CO_3+K_2CO_3+H_2O\)

Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
2Cu+O2to→2CuO2Cu+O2→to2CuO
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
O2+2H2to→2H2OO2+2H2→to2H2O
+ Tác dụng với một số phi kim khác:
4P+5O2to→2P2O54P+5O2→to2P2O5
+ Tác dụng với một số hợp chất:
C2H5OH+3O2to→2CO2+3H2OC2H5OH+3O2→to2CO2+3H2O
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
3Fe+2O2to→Fe3O43Fe+2O2→toFe3O4
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
2KClO3to→3O2↑+2KCl

1: Tác dụng được với nước:
Na2O + H2O -> 2NaOH
2: Tác dụng đươc với axit
Na2O + HCl -> NaCl + H2O
3: Tác dụng được với oxit axit
Na2O + SO2 -> Na2SO3
Tính chất hóa học:
- Na\(_2\)O là 1 oxit bazơ nên nó có đầy đủ tính chất hóa học của một oxit bazơ như:
+ Tác dụng với nước.
+ Tác dụng với oxit axit.
+ Tác dụng với axit . . .
1. Tác dụng với nước → dung dịch bazơ
- Na\(_2\)O tan được trong nước tạo thành dung dịch trong suốt, không màu không mùi, không vị. Dung dịch này có tính ăn mòn như làm mòn da, làm mòn vải . . . nên nó còn có tên gọi khác là xút ăn da.
Na\(_2\)O + H\(_2\)O → 2NaOH
2. Tác dụng với oxit axit → muối:
Ở trong môi trường bình thường Na\(_2\)O sẵn sàng tác dụng với những oxit axit khác để tạo thành hợp chất mới là muối.
Na\(_2\)O + CO\(_2\) → Na\(_2\)CO\(_3\)
3. Tác dụng với dung dịch axit → thành muối và giải phóng nước.
Na\(_2\)O + 2HCl → 2NaCl + H\(_2\)O
4. Tác dụng với oxi → peoxit; supeoxit.
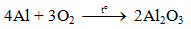
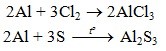
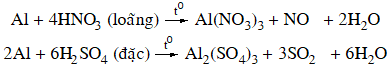
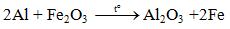
Tham khảo in đậm