Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Điều chế HF, HCl bằng cách cho H 2 SO 4 đặc tác dụng với muối florua, clorua vì H 2 SO 4 à chất oxi hoá không đủ mạnh để oxi hoá được HF và HCl. Nói cách khác, HF và HCl có tính khử yếu, chúng không khử được H 2 SO 4 đặc
Ca F 2 + H 2 SO 4 → Ca SO 4 + 2HF
NaCl + H 2 SO 4 → NaH SO 4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H 2 SO 4 đặc oxi hoá được những chất này thành Br 2 và I 2 . Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H 2 SO 4 → HBr + NaH SO 4
2HBr + H 2 SO 4 → Br 2 + SO 2 + 2 H 2 O
NaI + H 2 SO 4 → NaH SO 4 + HI
2HI + H 2 SO 4 → I 2 + SO 2 + 2 H 2 O

A:NaHSO4
B:Na2SO3
C:BaS
2NaHSO4+Na2SO3→2Na2SO4+SO2↑+H2O
Na2SO3+BaS→BaSO3↓+Na2S
2NaHSO4+BaS→BaSO4↓+H2S↑+Na2SO4

Người ta có thể điều chế Cl 2 , Br 2 , I 2 bằng cách cho hỗn hợp dung dịch H 2 SO 4 đặc và MnO 2 tác dụng với muối clorua, bromua, iotua
Các sản phẩm trung gian là HCl, HBr, HI bị hỗn hợp ( MnO 2 + H 2 SO 4 ) oxi hoá thành Cl 2 , Br 2 , I 2 . Các PTHH có thể viết như sau :
NaCl + H 2 SO 4 → Na HSO 4 + HCl
MnO 2 + 4HCl → Mn Cl 2 + Cl 2 + 2 H 2 O
Các phản ứng cũng xảy ra tương tự đối với muối NaBr và NaI.
Không thể áp dụng phương pháp trên để điều chế F 2 vì hỗn hợp oxi hoá ( MnO 2 + H 2 SO 4 ) không đủ mạnh để oxi hoá HF thành F 2
Cách duy nhất điều chế F 2 là điện phân KF tan trong HF lỏng khan Dùng dòng điện một chiểu 8-12 von ; 4000 - 6000 ampe ; Bình điện phân có catôt làm bằng thép đặc biệt hoặc bằng đồng và anôt làm bằng than chì (graphit).
Ở catot: 2 H + + 2 e → H 2
Ở anot: 2 F - → F 2 + 2 e

a) $n_{Mg} = \dfrac{4,8}{24} = 0,2(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH :
$n_{HCl} = 2n_{Mg} = 0,4(mol) \Rightarrow m_{HCl} = 0,4.36,5 = 14,6(gam)$
b)
$n_{MgCl_2} = n_{Mg} = 0,2(mol) \Rightarrow m_{MgCl_2} = 0,2.95 = 19(gam)$
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 0,2.......0,4........0,2.........0,2\left(mol\right)\\ a.m_{HCl}=0,4.36,5=14,6\left(g\right)\\ b.m_{MgCl_2}=0,2.95=19\left(g\right)\)

Anh đang cầm điện thoại ở nhà tắm nên anh không tiện gõ latex.
Bé thông cảm!
Câu 1: Cl2 + H2O -> (p.ứ 2 chiều) HCl + HClO
Số oxh clo từ 0 lên +1 (HClO), giảm xuống -1 (HCl)
=> Vừa có tính khử (tăng) 🙄, vừa có tính oxh (giảm)
=> chọn C
Câu 2:
Dùng muối Na2CO3 là hợp lí nhất: Nó sẽ tạo khí không màu CO2 (nhận biết HCl), tạo dd hoặc kết tủa (nhận biết muối clorua).
=> Chọn B
Câu 3: Chọn D
Câu 4: Cl trước phản ứng có số oxh 0
Cl sau phản ứng có số oxh -1
=> Giảm số oxh => Chất oxh
=> Chọn A
Câu 5: Chọn C

Giải thích các hiện tượng sau viết PTPƯ
a)Cho luồng khí clo qua dung dịch kali bromua một thời gian dài
PTHH: \(Cl_2+2KBr\rightarrow KCl+Br_2\)
Hiện tượng : Khí màu vàng lục (Cl2) tan dần và dung dịch chuyển sang màu nâu đỏ của Bromua (Br2).
b) Thêm dần dần nước clo vào dung dịch kali iotua có chứa sẵn một ít tinh bột
- Khí Cl2 oxi hóa KI thành I2, Cl2 và I2 tan trong nước, do đó xuất hiện dung dịch màu vàng nâu.
Cl2 + 2KI → 2KCl + I2
- Sau đó dung dịch vàng nâu chuyển sang màu xanh do dung dịch có chứa iot.
- Do thêm dần dần nước clo, nên màu xanh của hồ tinh bột và iot cũng bị mất màu, do một phần khí Cl2 tác dụng với nước tạo ra axit HClO có tính oxi hóa mạnh, axit này làm mất màu xanh của tinh bột và iot.
Cl2 + H2O ⇌ HCl + HClO
c) dùng bình thủy tinh dung dịch HF được ko? Tại sao
Không được vì HF tác dụng với thủy tinh ( thành phần chính là SiO2)
\(4HF+SiO_2\rightarrow SiF_4+2H_2O\)

1. Cho 8,7 gam Manganđioxit tan trong axit HCl dư, đun nóng. Thể tích khí H2 (đktc) và khối lượng muối thu được là
A. 2,24 lít và 12,6 gam
B. 4,48 lít và 16,2 gam
C. 2,24 lít và 8,1 gam
D. 2,24 lít và 1,62 gam
Giải
Sơ đồ: \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(\Rightarrow n_{MnO}=n_{Cl2}=n_{MnO2}=0,1\left(mol\right)\)
\(\Rightarrow V=0,1.22,4=2,24\left(l\right)\)
\(\Rightarrow m_{MnCl2}=12,6\left(g\right)\)
2.Trộn 2 khí với tỷ lệ thể tích 1:1 ngoài ánh sáng mặt trời thì có hiện tượng nổ. Hai khí đó là 2 khí nào trong số các khí sau?
A. N2 và H2 B. O2 và H2 C. Cl2 và H2 D. Cl2 và H2S
P/s : Phản ứng nổ của hỗn hợp Cl2, H2 1:1
3. Hòa tan 2,24 lít khí hiđroclorua (đktc) vào 46,35 gam nước thu được dung dịch axit clohiđric có nồng độ là
A. 73% B. 7,3% C. 2,15% D. 7,874%
Giải :
\(n_{HCl}=0,1\left(mol\right)\)
\(C\%_{HCl}=\frac{0,1.36,5}{0,1.36,5+46,35}.100\%=7,3\%\)
4. Khi cho 10,5 gam Natri iotua vào 50 ml dung dịch nước Brom 0,5M. Khối lượng Natri bromua thu được là
A. 3,45 gram
B. 4,67 gram
C. 5,15 gram
D. 8,75 gram
Giải :
\(n_{NaI}=0,07\left(mol\right)\)
\(n_{Br2}=0,025\left(mol\right)\)
\(Br_2+2NaI\rightarrow2NaBr+I_2\)
\(\Rightarrow\) Dư NaI. Tạo 0,05 mol NaBr
\(\Rightarrow m_{NaBr}=5,15\left(g\right)\)
5. Đốt cháy hoàn toàn 11,2 gam kim loại R trong khí clo dư thu được 32,5 gam muối clorua. Nếu hòa tan hoàn toàn lượng kim loại R trên trong dung dịch HCl dư thì thể tích H2 thu được ở đktc là
A. 6,72 l B. 2,24 l C. 8,96 l D. 4,48 l
Giải :
\(m_{Cl2}=32,5-11,2=21,3\left(g\right)\)
\(\Rightarrow n_{Cl2}=0,3\left(mol\right)\)
\(2R+xCl_2\rightarrow2RCl_x\)
\(n_R=\frac{0,6}{x}\left(mol\right)\)
\(M_R=\frac{11,2x}{0,6}=\frac{56x}{3}\)
\(x=3\Rightarrow M_R=56\left(Fe\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow n_{H2}=n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow V=0,2.22,4=4,48\left(l\right)\)
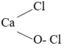
Cho các chất đó tác dụng với dd AgNO3
- Nếu là muối clorua hoặc HCl thì tạo kết tủa trắng AgCl.
- Nếu là muối bromua hoặc HBr thì tạo kết tủa vàng nhạt AgBr.
- Nếu là muối iotua hoặc HI thì tạo kết tủa vàng AgI.
axit tương ứng thì sao