Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(PTHH:Fe+HCL\) → \(FeCl_2+H_2\)
Cân bằng: \(Fe+2HCl\) → \(FeCl_2+H_2\)
b) \(n_{Fe}=\dfrac{m}{M}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=2.n_{Fe}=2.0,1=0,2\left(mol\right)\)
\(m_{HCl}=n.M=0,2.36,5=7,3\left(g\right)\)
c) \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(V_{H_2\left(đktc\right)}=n.22,4=0,1.22,4=2,24\left(l\right)\)

Câu 1:
\(a,PTHH:Mg+2HCl\to MgCl_2+H_2\\ b,m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\\ \Rightarrow m_{HCl}=9,5+0,2-2,4=7,3(g)\)
Câu 2:
\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\\ \Rightarrow m_{ZnCl_2}=13+14,6-0,4=27,2(g)\)

Phương trình hóa học: 2NaOH + H 2 S O 4 → N a 2 S O 4 + 2 H 2 O

a) Mg + H2SO4 → MgSO4 + H2
b) nMg = \(\dfrac{7,2}{24}\)= 0,3 mol . Theo tỉ lệ phản ứng => nMgSO4 = 0,3 mol
<=> mMgSO4 = 0,3 . 120 = 36 gam
c) nH2 = nMg = 0,3 mol
=> V H2 = 0,3.22,4 = 6,72 lít

a) \(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b) Theo định luật bảo toàn khối lượng, ta có:
\(m_{Al}+m_{H_2SO_4}=m_{Al_2\left(SO_4\right)_3}+m_{H_2}\\ \Rightarrow27+m_{H_2SO_4}=171+3\\ \Rightarrow m_{H_2SO_4}=171+3-27=147\left(g\right)\)
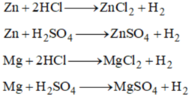
Axit clohidric được ứng dụng rộng rãi trong đời sống và sản xuất:
– Điều chế muối clorua
– Làm sạch, tẩy gỉ bề mặt kim loại trước khi sơn, mạ hay hàn…
– Dùng trong chế biến dược phẩm, thực phẩm…
– Dùng để sản xuất nhiều hợp chất hữu cơ và vô cơ quan trọng.
Axit sunfuric có nhiều ứng dụng rộng rãi trong đời sống, sản xuất và trong công nghiệp:
– Sản xuất phân bón, thuốc trừ sâu, thuốc nhuộm, chất tẩy rửa tổng hợp.
– Dùng trong công nghiệp sản xuất giấy, chất dẻo, tơ sợi
– Dùng trong chế biến dầu mỏ, công nghiệp luyện kim
– Sản xuất thuốc nổ, muối, axit
Ứng dụng của axit axetic: Axit axetic được dùng để điều chế phẩm nhuộm, thuốc diệt côn trùng, dược phẩm, tơ nhân tạo, chất dẻo,…