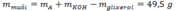Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Gọi CT của E là CnH2n+2-6-2kO6 (k là số liên kết pi trong gốc hidrocacbon)
Khi đốt cháy: CnH2n-4-2kO6 + O2 → nCO2 + (n – 2 – k) H2O
Lại có: nCO2 – nH2O = y – z = 5nE = (n – n + 2 + k)nE
=> k = 3
=> Este phản ứng với Brom tối đa theo tỉ lệ 1: 3
Ta có: nBr2 = 72: 160 = 0,45 mol => nEste = 1/3.nBr2 = 0,15 mol
Bảo toàn khối lượng: meste = msản phẩm – mBr2 = 110,1 – 72 = 38,1g
Áp dụng phương pháp tăng giảm khối lượng: Gốc Axit-C3H5 + K → Gốc Axit-K + C3H5
nC3H5 = nC3H5(OH)3 = neste = 0,15 mol ; nK = nKOH = nCOO = 3neste = 0,45 mol
=> mmuối = meste + mK – mC3H5 = 38,1 + 0,45.39 – 0,15.41 = 49,5g

Đáp án D
Phương pháp:
Sử dụng công thức tính: Đốt cháy hợp chất hữu cơ: CxHyOz có độ bất bão hòa k khi
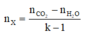
Từ mối quan hệ của CO2; H2O và nE ⇒ k = ?
Viết PTHH, tính toán theo PTHH
Hướng dẫn giải:
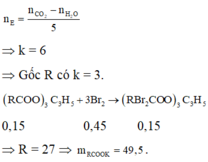

Chọn đáp án A
Ta có công thức: n E s t e = n C O 2 - n H 2 O k - 1
⇒ k = 7.
Vì có 3π/COO
⇒ Este này có (7–3) = 4π/C-C.
⇒ Este này + tối đa với Br2 theo tỉ lệ mol 1:4
Mà n B r 2 = 0 , 08 m o l
⇒ nEste = 0,02 mol.
BTKL ta lại có:
mEste = 18,12 – 12,8 = 5,32 gam
Phản ứng của este với NaOH:
Este + 3NaOH → Muối + 1Glixerol
Với nNaOH = 0,06 mol và
nGlixerol = 0,02 mol
BTKL ⇒ n = 5 , 32 + 0 , 06 × 40 – 0 , 02 × 92 = 5 , 88 g a m
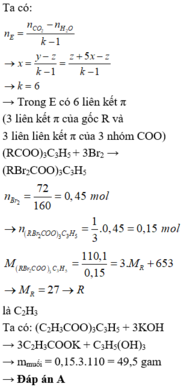

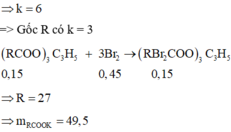
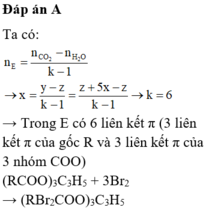
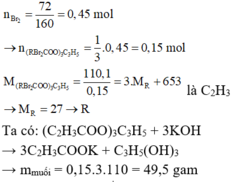


Đáp án D
Do b-d=5a
=>Số liên kết pi trong A=5+1=6
=>Số liên kết pi trong gốc hidrocacbon = 6-3=3
Khi A phản ứng với KOH =>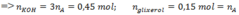
Bảo toàn khối lượng: