Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1 :
Gọi $n_{SO_3} = a(mol)$
$SO_3 + H_2O \to H_2SO_4$
Sau khi pha :
$m_{dd} = 80a + 200(gam)$
$m_{H_2SO_4} = 98a + 200.9,8\% = 98a + 19,6(gam)$
Suy ra : $C\%_{H_2SO_4} = \dfrac{98a + 19,6}{200 + 80a}.100\% = 49\%$
$\Rightarrow a = 1,333(mol)$
$m_{SO_3} = 1,333.80 = 106,64(gam)$
Gọi $m_{oleum} = a(gam) ; m_{H_2SO_4} = b(gam)$
Ta có :
Sau khi trộn :
$m_{oleum} = a + b(gam)$
$m_{SO_3} = a.71\% = 0,71a(gam)$
$\Rightarrow \%SO_3 = \dfrac{0,71a}{a + b}.100\% = 62\%$
$\Rightarrow a + b = 0,4402a$
$\Rightarrow \dfrac{a}{b} = \dfrac{1}{1 - 0,4402} = 1,78$

1. \(n_{H_2SO_4\left(98\%\right)}=\dfrac{30.1,84.98\%}{98}=0,552\left(mol\right)\)
=>\(V_{H_2SO_4\left(1M\right)}=\dfrac{0,552}{1}=0,552\left(l\right)\)

nH2SO4 = 1,8mol
H2SO4 + 3SO3 → H2SO4.3SO3 (oleum)
1,8 → 5,4
m = 5,4 . 80 = 432g

Gọi nSO3 trong oleum ban đầu là x (mol)
mH20 trong dung dịch H2SO4 96,4% là : \(\frac{100.\left(100-96,4\right)}{100}=3,6\) (g)
nH20 ................................................... là : \(\frac{3,6}{18}=0,2\) (mol)
Ta có : H20 + SO3 -> H2SO4
0,2 -> 0,2 -> 0,2 (mol)
mSO3 sau khi hấp thụ là : (x - 0,2).80 (g)
m oleum sau khi hấp thụ là : 100 + (98 + 80)x = 100 + 178x (g)
%SO3 = \(\frac{\left(x-0,2\right)80}{100+178x}=\frac{5,22}{100}\)
=> x = 0,3 (mol)
Giá trị của m là : 0,3.(98+80) = 53,4 (g)

xin lỗi bạn Linhh Phương thực ra bài này có 1 đoạn mình tính thiếu :
ta có CTHH của oleum là H2SO4.3H2O ;
thì khi hòa tan và 120g dd H2SO4 10% thì khối lượng H2SO4 trong dd tạo thành phải là a/338 * 4*98 + 120*10%=196a/169 +12(g)
mdd thu được = 120 +a(g)
--> (196a/169 +12) /(120 +a) =20%
--> a=12,5(g)
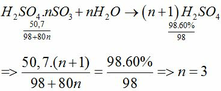

Tham khảo
Khối lượng oleum chứa 71% SO3 về khối lượng cần lấy để hòa tan vào 100 gam dung dịch H2SO4 60% thì thu được oleum chứa 30% SO3 về khối lượng là:
A. 506,78gam B. 312,56 gam C. 539,68gam D. 496,68gam
Giải
x mol SO3 ,m g oleum -->80x/m = 0,71
mH2O=40 g--->nH2O=20/9 mol
SO3 + H2O--->H2SO4
--> n SO3 dư =x-20/9 ----> 80(x-20/9)/(m+100)=0,3
---->m=506,78gam