
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

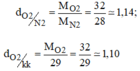

a.\(\dfrac{M_{O_2}}{M_{H_2}}=\dfrac{32}{2}=16\)
b.\(\dfrac{M_{N_2}}{29}=\dfrac{28}{29}=0,96\)

Coi $n_A = 1(mol) \Rightarrow m_A = 1.2.13,5 = 27(gam)$
$m_{NH_3} + m_{O_2} + m_{N_2} = 27$
$\Rightarrow \dfrac{7}{8}m_{O_2} + m_{O_2} + \dfrac{3}{6} (m_{O_2} + m_{NH_3} ) = 27$
$\Rightarrow \dfrac{7}{8}m_{O_2} + m_{O_2} + \dfrac{3}{6} (m_{O_2} + \dfrac{7}{8}m_{O_2} ) = 27$
$\Rightarrow \dfrac{45}{16}m_{O_2} = 27 \Rightarrow m_{O_2} = 9,6(gam)$
Suy ra:
$m_{NH_3} = 8,4 ; m_{N_2} = 9$
Suy ra : $n_{O_2} = 0,3(mol) ; n_{NH_3} = \dfrac{42}{85}(mol)$
$\%V_{O_2} = \dfrac{0,3}{1}.100\% = 30\%$
$\%V_{NH_3} = 49,41\%$
$\%V_{N_2} = 20,59\%$

1% là các khí khác chứ không phải riêng CO2 bn nhé
Giả sử có 1 mol không khí
\(n_{N_2}=\dfrac{1.78}{100}=0,78\left(mol\right)\)
\(n_{O_2}=\dfrac{21.1}{100}=0,21\left(mol\right)\)
\(\overline{M}_{kk}=\dfrac{0,78.28+0,21.32}{1}\approx29\)