
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Mấy bài dạng này em cứ tính số mol chất đó, sau đó áp dụng công thức là ra nhé! Nhớ đổi ml ra lít
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\\ C_{M_{H_2SO_4}}=\dfrac{0,2}{0,4}=0,5\left(M\right)\)

\(m_{H_2SO_4}=200.19,6\%=39,2\left(g\right)\\ m_{ddH_2SO_4\left(98\%\right)}=\dfrac{39,2}{98\%}=40\left(g\right)\\ m_{H_2O\left(bđ\right)}=40-39,2=0,8\left(g\right)\\ m_{H_2O\cdot\left(thêm\right)}=200-40=160\left(g\right)\)
pp: lấy 40 g ddH2SO4 đặc (98%), đong lấy 160 g nước, cho nước vào bình nghiệm rồi rót từ từ ddH2SO4 vào rồi khuấy đều

a) Số mol của 11,2 gam Fe:
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
1 : 1 : 1 : 1
0,2-> 0,2 : 0,2 : 0,2 (mol)
Khối lượng của 0,2 mol H2:
\(m_{H_2}=n.M=0,2.2=0,4\left(g\right)\)
b) khồi lượng của 0,2 mol H2SO4:
\(m_{H_2SO_4}=n.M=0,2.98=19,6\left(g\right)\)
Nồng độ phần trăm của dd:
\(C\%_{H_2SO_4}=\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{19,6}{200}.100\%=9,8\%\)

a, \(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(m_{NaOH}=0,2.40=8\left(g\right)\)
b, \(n_{H_2SO_4}=2.0,1=0,2\left(mol\right)\)
\(c,C\%=\dfrac{6}{200}.100\%=3\%\)
\(m_{NaCl}=\dfrac{200.8}{100}=16\left(g\right)\)

\(n_{Fe_2O_3}=\dfrac{3,2}{160}=0,02(mol)\\ PTHH:Fe_2O_3+3H_2SO_4\to Fe_2(SO_4)_3+3H_2\\ \Rightarrow n_{H_2SO_4}=3n_{Fe_2O_3}=0,06(mol)\\ \Rightarrow m_{dd_{H_2SO_4}}=\dfrac{0,06.98}{19,6\%}=30(g)\)

a) \(n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(C_{M_{ddCuSO_4}}=\dfrac{0,1}{0,2}=0,5M\)
b) \(m_{H_2SO_4}=\dfrac{150.14}{100}=21\left(g\right)\)
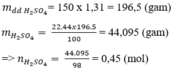
m H2SO4 = 400.19,6% = 78,4 gam
n H2SO4 = 78,4/98 = 0,8(mol)