
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H^+}=0,2.\left(0,02+0,01.2\right)=0,008\left(mol\right)\)
\(n_{OH^-}=0,3.2.0,04=0,024\left(mol\right)\)
\(n_{OH^-dư}=0,3.2.0,04=0,016\left(mol\right)\)
\(\Rightarrow\left[OH^-_{dư}\right]=\dfrac{0,016}{0,5}=0,032M\)
\(\Rightarrow\left[H^+\right]=3,125.10^{-13}M\)
\(\Rightarrow pH\approx12,5\)

Đáp án D
nH2SO4 = 0,005 .0,25 =0,00125(mol)
nHCl = 0,01. 0,25= 0,0025 (mol)
∑n= 0,00125 + 0,0025= 0,00375 (mol)
∑n= 0,001.0,2 + 0,0005.2.0,2=0,0004
H+ + OH- → H2O
Ban đầu: 0,00375 0,0004
Phản ứng: 0,0004 0,0004
Sau phản ứng: 0,00335 0
Vsau = 0,2 + 0,25= 0,45(lít)
Mà 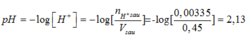

a)
- Dung dịch X:
HCl → H+ + Cl-
0,04M → 0,04M
→ [H+] = 0,04M
→ pH = -log[H+] = -log(0,04) ≈ 1,4
- Dung dịch Y:
NaOH → Na+ + OH-
0,02M ______0,02M
Ba(OH)2 → Ba2+ + 2OH-
0,01M_________0,02M
→ [OH-] = 0,02 + 0,02 = 0,04M
→ pOH = -log[OH-] = -log(0,04) ≈ 1,4
→ pH = 14 - pOH = 14 - 1,4 ≈ 12,6
b)
300 ml X có: nH+ = nHCl = 0,3.0,04 = 0,012 mol
200 ml Y có: nOH- = nNaOH + 2nBa(OH)2
= 0,2.0,02 + 2.0,2.0,01 = 0,008 mol
PT ion: H+ +OH- → H2O
Bđ:__0,012__0,008
Pư: __0,008__0,008
Sau:__0,004 ___0
→ [H+] =\(\frac{0,004}{0,3+0,2}\) = 0,008M
→ pH = -log(0,008) ≈ 2,1

Ta có: \(\left\{{}\begin{matrix}n_{Ba^{2+}}=n_{Ba\left(OH\right)_2}=0,1.0,01=0,001\left(mol\right)\\n_{OH^-}=2n_{Ba\left(OH\right)_2}=2.0,1.0,01=0,002\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\Sigma n_{H^+}=0,2.0,01+2.0,2.0,02=0,01\left(mol\right)\\n_{SO_4^{2-}}=n_{H_2SO_4}=0,2.0,02=0,004\left(mol\right)\end{matrix}\right.\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
_____ 0,01___0,002_________ (mol)
⇒ H+ dư. \(\Rightarrow n_{H^+\left(dư\right)}=0,008\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\frac{0,008}{0,3}=\frac{2}{75}M\Rightarrow pH\approx1,57\)
PT ion: \(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_{4\downarrow}\)
______ 0,001__0,004__ → 0,001 (mol)
\(\Rightarrow m_{\downarrow}=m_{BaSO_4}=0,001.233=0,233\left(g\right)\)
Bạn tham khảo nhé!

Ta có: \(\left[H^+\right]=0,01+0,02\cdot2=0,05\left(M\right)\) \(\Rightarrow pH=-log\left(0,05\right)\approx1,3\)