Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{NaOH\left(A\right)}=20.5\%=1\left(g\right)\)
Trong B:
gọi x là khối lượng Na2O thêm vào , x>0 (g)
\(10\%=\dfrac{\dfrac{80}{62}x+1}{x+20}\)
\(\rightarrow x=0,84\left(g\right)\)
Vậy khối Na2O thêm vào dd A là 0,84 (g)
b, \(m_{KOH\left(A\right)}=2\%.20=0,4\left(g\right)\)
\(C\%_{KOH\left(B\right)}=\dfrac{0,4}{20+0,84}.100\%=1,92\%\)

Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,4 0,2 0,2
a) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl= nHCl . MHCl
= 0,4 . 36,5
= 14,6 (g)
Khối lượng của dung dịch axit clohidric cần dùng
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,6.100}{7,3}=200\left(g\right)\)
b) Số mol của muối sắt (II) clorua
nFeCl2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2= nFeCl2 . MFeCl2
= 0,2 . 127
= 25,4 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mHCl - mH2
= 11,2 + 200 - ( 0,2 .2)
= 210,8 (g)
c) Nồng độ phần trăm của muối sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{25,4.100}{210,8}=12,05\)0/0
d) Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{7,3.300}{100}=21,9\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,6 0,3 0,3
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
⇒ Fe phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Fe
Sau phản ứng thu được muối FeCl2 và dung dịch HCl còn dư
Số mol của sắt (II) clorua
nFeCl2 = \(\dfrac{0,6.1}{2}=0,3\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2 = nFeCl2 . MFeCl2
= 0,3 . 127
= 38,1 (g)
Số mol dư của dung dịch axit clohidric
ndư = nban đầu - nmol
= 0,6 - (0,2 . 2)
= 0,2 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư = ndư. MHCl
= 0,2 . 36,5
= 7,3 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mHCl - mH2
= 11,2 + 300 - (0,3 . 2)
= 310,6 (g)
Nồng độ phần trăm của sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{38,1.100}{310,6}=12,27\)0/0
Nồng độ phần trăm của dung dịch axit clohdric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{7,3.100}{310,6}=2,35\)0/0
Chúc bạn học tốt

\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{13}{65}=0,2mol\)
PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
TL: 1 : 2 : 1 : 1
mol: 0,2 \(\rightarrow\) 0,1 \(\rightarrow\) 0,2 \(\rightarrow\) 0,2
đổi 500ml = 0,5 l
\(a.C_{M_{ddHCl}}=\dfrac{n_{HCl}}{V_{HCl}}=\dfrac{0,1}{0,5}=0,2M\)
\(b.m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
c.
Màu của quỳ tím sẽ chuyển sang màu đỏ.
Giải thích:
- Phản ứng giữa axit HCl và bazơ KOH tạo ra muối KCl và nước: HCl + KOH → KCl + H2O
- Vì dung dịch KOH là bazơ, nên khi phản ứng với axit HCl thì sẽ tạo ra dung dịch muối KCl và nước.
- Muối KCl không có tính kiềm, nên dung dịch thu được sẽ có tính axit.
- Khi cho mẫu quỳ tím vào dung dịch axit, quỳ tím sẽ chuyển sang màu đỏ do tính axit của dung dịch.
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2----->0,4------>0,2---->0,2
a) \(C_{MddHCl}=\dfrac{0,4}{0,5}=0,8M\)
b) \(m_{muối}=m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{KOH}=\dfrac{5,6\%.200}{100\%.56}=0,2\left(mol\right)\)
Pt : \(KOH+HCl\rightarrow KCl+H_2O\)
0,2 0,4
Xét tỉ lệ : \(0,2< 0,4\Rightarrow HCldư\)
Khi cho quỳ tím vào dụng dịch sau phản ứng --> quỳ hóa đỏ (do HCl có tính axit)

a)
Do A và B đều là kim loại hóa trị II nên ta sử dụng phương pháp trung bình coi A và B là một chất gọi là X
=> CT chung của 2 muối là XCO3
Ta có nCO2 = \(\dfrac{1,12}{22,4}\) = 0,05 ( mol )
XCO3 + H2SO4 → XSO4 + H2O + CO2
0,05 <---- 0,05 <---0,05 <-- 0,05 < -0,05
bảo toàn khối lượng ta có
mXSO4 = mXCO3 + mH2SO4 - mH2O - mCO2
= 4,68 + ( 98 . 0,05 ) - ( 18 . 0,05 ) - ( 44 . 0,05 )
= 6,48 ( gam )
b) MXCO3 = mXCO3 : nXCO3 = 4,68 : 0,05 = 93,6
=> X = 93,6 - 12 - 16 . 3 = 33,6
có nACO3 : nBCO3 = 2 : 3
và nACO3 + nBCO3 = 0,05
=> nACO3 = 0,02 và nBCO3 = 0,03
=> nA = 0,02 và nB = 0,03
=> ( 0,02 . A + 5 : 3 . 0,03 . B) / 0,05 = 33,6
=> A = 24 ( là magie - Mg ) do B = A . 5 :3
=> B = 40 ( là canxi - Ca )
=> mMgCO3 = 1,68 ( gam )
=> %mMgCO3 = \(\dfrac{1,68}{4,68}\) . 100 \(\approx\) 36 %
=> %mCaCO3 = 100 - 36 = 64%

PT: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 27y = 12,6 (1)
Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}y\left(mol\right)\)
\(\Rightarrow x+\dfrac{3}{2}y=0,6\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{MG}=\dfrac{0,3.24}{12,6}.100\%\approx57,1\%\\\%m_{Al}\approx42,9\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{H_2SO_4}=n_{H_2}=0,6\left(mol\right)\\n_{MgSO_4}=n_{Mg}=0,3\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{H_2SO_4}=0,6.98=58,8\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{58,8}{14,7\%}=400\left(g\right)\)
Ta có: m dd sau pư = 12,6 + 400 - 0,6.2 = 411,4 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{0,3.120}{411,4}.100\%\approx8,75\%\\C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1.342}{411,4}.100\%\approx8,31\%\end{matrix}\right.\)
Bạn tham khảo nhé!
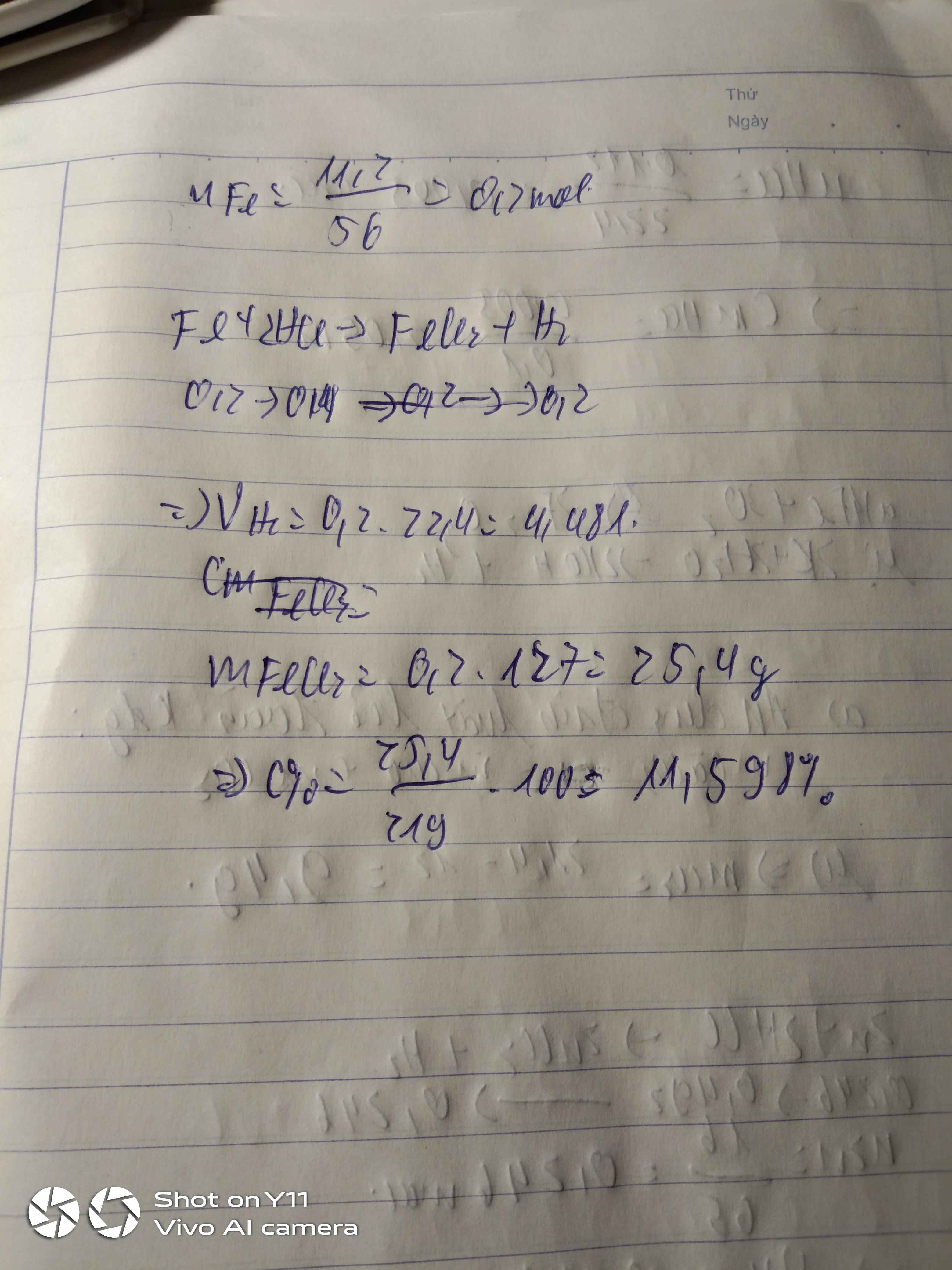
Dạng bài tập P2O5 tác dụng với dd NaOH hoặc KOH thực chất là axit H3PO4 (do P2O5 + H2O trong dd NaOH ) tác dụng với NaOH có thể xảy ra các phản ứng sau :
H3PO4 + NaOH ------->NaH2PO4 + H2O (1)
H3PO4 + 2NaOH -------> Na2HPO4 + 2H2O (2)
H3PO4 + 3NaOH -------> Na3PO4 + 3H2O (3)
TN1:
\(n_{P_2O_5}=\dfrac{12,78}{142}=0,09\left(mol\right);n_{NaOH}=\dfrac{80.5\%}{40}=0,1\left(mol\right)\)
P2O5 + 3H2O --------> 2H3PO4
Tỉ lệ : \(\dfrac{n_{NaOH}}{n_{H_3PO_4}}=\dfrac{0,1}{0,09.2}=0,56\)
=> Chỉ xảy ra phản ứng (1) taọ ra NaH2PO4và H3PO4 còn dư
mdd sau = mP2O5+ mNaOH = 12,78 + 80= 92,78(g)
m NaH2PO4 = 0,09.120= 10,8 (g)
\(C\%_{NaH_2PO_4}=\dfrac{0,09.120}{92,78}.100=11,64\%\)
TN2:
\(n_{KOH}=\dfrac{106,4.10\%}{56}=0,19\left(mol\right);n_{P_2O_5}=\dfrac{7,1}{142}=0,05\left(mol\right)\)
BTNT P: nH3PO4 = 2nP2O5 = 2.0,05 = 0,1 (mol)
\(\dfrac{n_{KOH}}{n_{H_3PO_4}}=\dfrac{0,19}{0,1}=1,9\)
=>Xảy ra cả phản ứng(1) và phản ứng (2) tạo ra KH2PO4 (x_mol) và K2HPO4(y_mol)
H3PO4 + KOH ------->KH2PO4 + H2O (1)
H3PO4 + 2KOH -------> K2HPO4 + 2H2O (2)
Ta có : \(\left\{{}\begin{matrix}x+y=0,1\\x+2y=0,19\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,01\\y=0,09\end{matrix}\right.\)
mdd sau = mP2O5+ mKOH =7,1 + 106,4= 113,5 (g)
=> m KH2PO4 = 0,01.253=2,53 (g)
m K2HPO4 = 0,09.174=15,66(g)
=>\(C\%_{KH_2PO_4}=\dfrac{0,01.253}{113,5}.100=2,23\%\)
\(C\%_{K_2HPO_4}=\dfrac{0,09.174}{113,5}.100=13,79\%\)
TN 1 : Số mol của đi phốt pho pentaoxit
nP2O5 = \(\dfrac{m_{P2O5}}{M_{P2O5}}=\dfrac{12,78}{142}=0,09\left(mol\right)\)
Khối lượng chất tan của dung dịch natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{5.80}{100}=4\left(g\right)\)
Số mol của natri hidroxit
nNaOH = \(\dfrac{m_{NaOH}}{M_{NaOH}}=\dfrac{4}{40}=0,1\left(mol\right)\)
Pt : P2O5 + 6NaOH \(\rightarrow\) 2Na3PO4 + 3H2O\(|\)
1 6 2 3
0,09 0,1
Lập tỉ số so sánh : \(\dfrac{0,09}{1}>\dfrac{0,1}{6}\)
\(\Rightarrow\) P2O5 dư , NaOH phản ứng hết
\(\Rightarrow\) Tính toán dựa vào số mol NaOH
Số mol của muối natri phốt phat
nNa3PO4 = \(\dfrac{0,1.2}{6}=0,03\left(mol\right)\)
Khối lượng của muối natri phốt phat
mNa3PO4 = nNa3PO4 . MNa3PO4
= 0,03 . 164
= 4,92 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mP2O5 + mNaOH
= 12,78 + 80
= 92,78 (g)
Nồng độ phần trăm của muối natri phốt phat
C0/0Na3PO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{4,92.100}{92,78}=5,3\)0/0
TN 2 : Khối lượng chất tan của dung dịch kaki hidroxit
C0/0KOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{10.106,4}{100}=10,64\left(g\right)\)
Số mol của kali hidroxit
nKOH = \(\dfrac{m_{KOH}}{M_{KOH}}=\dfrac{10,64}{56}=0,19\left(mol\right)\)
Số mol của đi phốt pho pentaoxit
nP2O5 = \(\dfrac{m_{P2O5}}{M_{P2O5}}=\dfrac{7,1}{142}=0,05\left(mol\right)\)
Pt : 6KOH + P2O5 \(\rightarrow\) 2K3PO4 + 3H2O\(|\)
6 1 2 3
0,19 0,05
Lập tỉ số sánh : \(\dfrac{0,19}{6}>\dfrac{0,05}{1}\)
\(\Rightarrow\) KOH dư , P2O5 phản ứng hết
\(\Rightarrow\) Tính toán dựa vào số mol P2O5
Số mol của muối kali photphat
nK3PO4 = \(\dfrac{0,05.2}{1}=0,1\left(mol\right)\)
Khối lượng của muối kali photphat
mK3PO4 = nK3PO4 . MK3PO4
= 0,1 . 212
= 21,2 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mKOH + mP2O5
= 106,4 + 7,1
= 113,5 (g)
Nồng độ phần trăm của muối kali photphat
C0/0K3PO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{21,2.100}{113,5}=18,67\) 0/0
Chúc bạn học tốt