Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

![]()
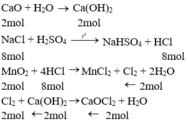
Phương trình hóa học của phản ứng:
Theo pt ⇒ nMnO2 = nCl2 = nCaOCl2 = 2 mol
mMnO2 = 87 x 2 = 174 g
nH2SO4 = nHCl = 4. nCl2 = 8 mol.
⇒ mH2SO4 = 8 x 98 = 784g
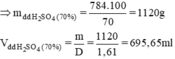
nNaCl = nHCl = 4. nCl2 = 8mol.
→ mNaCl = 8 x 58,5 = 468g.
nCaO = nCa(OH)2 = nCl2 = 2 mol.
→ mCaO = 2 x 56 = 112g.

pthh:
\(CaCO_3\underrightarrow{t^o}CaO+CO_2\left(1\right)\)
\(0,15\leftarrow\)----------------0,15 (mol)
\(CaO+2HCl\rightarrow CaCl_2+H_2O\left(2\right)\)
\(0,15\leftarrow\)---0,3 (mol)
\(nHCl=0,3.1=0,3\left(mol\right)\)
pt (2) \(\Rightarrow nCaO=\dfrac{1}{2}.nHCl=\dfrac{1}{2}.0,3=0,15\left(mol\right)\)
pt(1) \(\Rightarrow nCaCO_3=nCaO=0,15\left(mol\right)\)
\(\Rightarrow mCaCO_3=0,15.100=15\left(g\right)\)

=
= 2 mol
Phương trình hóa học của phản ứng:
CaO + H2O → Ca(OH)2
2 mol 2 mol
NaCl + H2SO4 NaHSO4 + HCl
8 mol 8 mol
MnO2+ 4HCl → MnCl2 + Cl2 +2H2O
2mol 8mol ← 2 mol
Cl2 + Ca(OH)2 → CaOCl2 + H2O
2 mol ←2 mol ← 2 mol
Khối lượng các chất:
= 87 x 2 = 174 g
= 8 mol →
= 8 x 98 = 784 g
= \(\frac{784.100}{70.1,61}\) = 695,65ml
nNaCl = 8 mol → mNaCl = 8 x 58,5 = 468g
nCaO = 2 mol → mCaO = 56 x 2 = 112 g

H2SO4 + NaC l= Na2SO4 + HCl
HCl + MnO2= MnCl2 + Cl2+ H2O
Cl2 CaO +H2O = CaOCl2 + HCl
tính số mol CaOCl2 rồi làm ngược nên là ra

Đáp án A.
Sử dụng yếu tố diện tích tiếp xúc, diện tích tiếp xúc càng lớn, thời gian càng nhỏ.

lấy m=100g
=> mCaCO3=80 => n=0.8
n pứ=x => mCaO=56x
56x/(56x+(0.8-x)*100+20)=0.4565
=> x=0.6 =|> H=0.6/0.8=0.75=75%

Chọn đáp án A
Tốc độ tỉ lệ với bề mặt chất rắn → Đá vôi tan nhanh : (3) > (2) > (1)

`@` Trong phản ứng giữa đá vôi `(CaCO_3)` và axit clohidric `(HCl)`, xảy ra phản ứng trao đổi, tạo ra muối canxi clorua `(CaCl_2)`, khí cacbon dioxide `(CO_2)` và nước `(H_2O)` theo phương trình hóa học sau:
`CaCO_3 + 2HCl → CaCl_2 + CO_2 + H_2O`
`@` Trong quá trình phản ứng, các phân tử của axit clohidric tác động lên các phân tử của đá vôi, gây ra sự phân hủy của chúng. Cụ thể, axit clohidric tác động lên ion canxi trong đá vôi, tạo ra muối canxi clorua và giải phóng khí cacbon dioxide.
`@` Vì khối lượng của khí `CO_2` thoát ra khỏi hỗn hợp phản ứng, nên khối lượng của sản phẩm tạo thành ít hơn khối lượng ban đầu của chất tham gia. Điều này được giải thích bởi định luật bảo toàn khối lượng, theo đó khối lượng của các chất tham gia phải bằng khối lượng của các sản phẩm tạo thành. Tuy nhiên, trong trường hợp này, khối lượng của sản phẩm tạo thành ít hơn khối lượng ban đầu của chất tham gia do khí `CO_2` thoát ra khỏi hỗn hợp phản ứng.
`=>` Khối lượng của chất tham gia lớn hơn khối lượng của sản phẩm tạo thành trong phản ứng giữa đá vôi và axit clohidric.

nCaOCl2 = 1000000 / 127 = 7874 mol.
Phương trình hóa học của phản ứng:
CaO + H2O →→ Ca(OH)2
NaCl + H2SO4 →→ NaHSO4 + HCl
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
Cl2 + Ca(OH)2 CaOCl2 + H2O
Khối lượng các chất:
mMnO2 = 87 x 7874 =685039 g.
nH2SO4 = 31496 mol. mH2SO4 = 31496 x 98 = 3086608g.
Vdd H2SO4 70% = 3086608x 100 / 70 x 1,06 = 41598,5ml.
nNaCl = 31496mol. →→mNaCl = 31496 x 58,5 = 1842516g.
nCaO = 7874mol. →→mCaO = 7874x 56 = 440944g.