Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Công thức oxit cao nhất là RO2
Có \(\dfrac{32}{M_R+32}.100\%=53,3\%=>M_R=28\left(Si\right)\)

HD:
CT oxit cao nhất của R với oxi là R2O5 (suy ra từ RH3).
Ta có: 80/(2R+80) = 0,5634 suy ra: R = 14 (N).
H:N:H H cấu tạo: H-N-H H
Hóa trị cao nhất vs khí H là 3
>> hóa trị cao nhất vs O là 8_3=5
>>hợp chất vs oxit cao nhất là R2O5
Có %mO=56.34%
Xét tỉ số MO/Mo+MR =%mo
Hay80/80+2×MR=0.5634
>>MR=14(N)
>>hợp chất vs oxit cao nhất là N2O5
b) hợp chất vs H là NH3

Hợp chất khí của R với hiđro có công thức phân tử là RH3.
Hợp chất oxit cao nhất của nguyên tố R là R2O5
Ta có \(\%O=\dfrac{16.5}{2R+16.5}.100=56,34\\ \Rightarrow R=31\left(Photpho-P\right)\\ \Rightarrow Z_R=SốE=15\)

B
Công thức hợp chất khí với H của R là R H 4 → công thức oxit cao nhất của R là R O 2 .
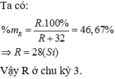



Hợp chất khí với hidro của R là RH4, vậy R thuộc nhóm IVA.
Công thức oxit cao nhất của R là RO2.
Trong RO2, oxi chiếm 53,33% khối lượng. Ta có:
(16 x 2) / (R + 16 x 2) = 0.5333
32 / (R + 32) = 0.5333
32 = 0.5333R + 17.0656
0.5333R = 32 - 17.0656 = 14.9344
R = 14.9344 / 0.5333 ≈ 28
Vậy khối lượng mol của R là xấp xỉ 28 g/mol.
Nguyên tố có khối lượng mol gần bằng 28 là Silic (Si), có số nguyên tử khối là 28.
Do đó, R là Silic (Si).