Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2yAl +3FexOy -to-> 3xFe + yAl2O3 (1)
phần 1 : Fe +4HNO3 --> Fe(NO3)3 + NO +2H2O (2)
Al2O3 + 6HNO3 --> 2Al(NO3)3 +3H2O (3)
Al +4HNO3 --> Al(NO3)3 +NO +2H2O (4)
P2 : Al2O3 +2NaOH --> 2NaAlO2 +H2O (5)
2Al +2H2O +2NaOH --> 2NaAlO2 +3H2 (6)
vì khi cho phần 2 td vs NaOH dư thấy giải phóng H2 => Al dư sau (1)
nH2=0,015(mol)
nFe(P2)=0,045(mol)
giả sử P1 gấp k lần P2
=> nFe(P1)=0,045k(mol)
theo (5) : nAl(P2)=2/3nH2=0,01(mol)
=>nAl(P1)=0,01k(mol)
nNO=0,165(mol)
theo (2,4) :nNO=(0,045k+0,01k) (mol)
=>0,055k=0,165=> k=3
=>nAl(P1)=0,03(mol)
nFe(p1)=0,135(mol)
\(\Sigma nFe=0,045+0,135=0,18\left(mol\right)\)
\(\Sigma nAl=0,03+0,01=0,04\left(mol\right)\)
mAl2O3=\(14,49-0,135.56-0,03.27=6,12\left(g\right)\)
nAl2O3(P1)=0,06(mol)
=> nAl2O3(P2)=0,02(mol)
\(\Sigma nAl2O3=0,08\left(mol\right)\)
theo (1) : nFe=3x/ynAl2O3
=> 0,18=3x/y.0,08=> x/y=3/4
=>CTHH : Fe3O4
theo (1) :nFe3O4 =1/3nFe=0,06(mol)
=>m=0,04.27+0,06.232=15(g)
bạn Lê Đình Thái ơi bạn giải nhầm tìm m rồi. Cái 0,04 mol đó là mol dư, bạn phải cộng với 0,16 mol phản ứng khi xảy ra phản ứng nhiệt phân nữa.
Kết quả là m=0,2.27+0,06.232=19,32 gam



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

a)
2Al + 6HCl → 2AlCl3 + 3H2↑
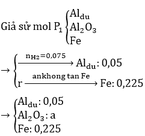
Pt: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Giả sử P2 = kP1
=> a=0.1
=> m = 128,8g
b)
2yAl + 3FexOy → yAl2O3 + 3xFe
0,1 0,225
=> 0,225y = 0,3x => 3y = 4x
=> Fe3O4

Khi cho vào NaOH có khí thoát ra chứng tỏ Al phản ứng dư. Hỗn hợp B bao gồm các chất: \(Fe,Al,Al_2O_3\)
Gọi số mol của \(Fe,Al,Al_2O_3\)trong phần 1 là: \(\left\{{}\begin{matrix}Fe:a\\Al:b\\Al_2O_3:c\end{matrix}\right.\), phần 2 là: \(\left\{{}\begin{matrix}Fe:na\\Al:nb\\Al_2O_3:nc\end{matrix}\right.\)
Phần 1:
Ta có: \(56a+27b+102c=14,49\left(1\right)\)
Quá trình nhường e:
\(Fe\left(a\right)\rightarrow Fe^{+3}+3e\left(3a\right)\)
\(Al\left(b\right)\rightarrow Al^{+3}+3e\left(3b\right)\)
Quá trình nhận e:
\(N^{+5}+3e\left(0,495\right)\rightarrow N^{+2}\left(0,165\right)\)
Theo bảo toàn e ta có:
\(3a+3b=0,495\left(2\right)\)
Phần 2:
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
\(2Al\left(0,01\right)+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2\left(0,015\right)\)
\(\Rightarrow nb=0,01\left(3\right)\)
Chất rắn không tan là Fe.
\(\Rightarrow na=\dfrac{2,52}{56}=0,045\left(4\right)\)
Từ (1), (2), (3), (4) ta có hệ:
\(\left\{{}\begin{matrix}56a+27b+102c=14,49\\3a+3b=0,495\\na=0,045\\nb=0,01\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,135\\b=0,03\\c=0,06\\n=\dfrac{1}{3}\end{matrix}\right.\)
Số mol của \(Fe,Al,Al_2O_3\) có trong B là:
\(\left\{{}\begin{matrix}n_{Fe}=0,135+\dfrac{0,135}{3}=0,18\\n_{Al}=0,03+\dfrac{0,03}{3}=0,04\\n_{Al_2O_3}=0,06+\dfrac{0,06}{3}=0,08\end{matrix}\right.\)
\(\Rightarrow m=0,18.56+0,04.27+0,08.102=19,32\left(g\right)\)
Số mol của Fe và O có trong hỗn hợp ban đầu là:
\(\left\{{}\begin{matrix}n_{Fe}=0,18\\n_O=3.0,08=0,24\end{matrix}\right.\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{0,18}{0,24}=\dfrac{3}{4}\)
Vậy oxit cần tìm là: \(Fe_3O_4\)
Đối với dạng bài mà cho hỗn hợp KL và oxit Kl phản ứng với axit thì thường giải bằng PP quy đổi và PP bảo toàn e.
Quy đổi hỗn hợp Al và FexOy thành Al, Fe, O.
Gọi số mol trong phần 1 của Al, Fe, O lần lượt là x, y, z.
Phần 1 có khối lượng 14,49g.
=> 27x + 56y +16z = 14,49 (1)
Áp dụng BT e
| Quá trình nhường e | Quá trình nhận e |
|
Al -> Al3+ + 3e x....................3x Fe -> Fe3+ +3e y..................3y |
O + 2e -> O2- z.....2z N+5 +3e -> N+2(NO) 0,495...0,165 |
Vì ne nhường = ne nhận
<=> 3x+3y = 2z+0,495 (2)
Phần 2 tác dụng với NaOH dư thấy có 0,336 lít H2 và 2,52 g chất rắn dư
Gọi a là tỉ lệ khối lượng giữa phần 2/phần 1 => \(a=\dfrac{m_{phần2}}{m_{phần1}}=\dfrac{n_2}{n_1}\)
=> nAl = nH2/1,5 = 0,01 mol = a.x (3) (viết PTHH ra thì sẽ thấy rõ)
mFe + mO = 2,52 => a.56y + a.16z = 2,52 (4)
Ta có hệ 4 pt (1), (2), (3), (4)
27x + 56y +16z = 14,49 (1)
3x+3y = 2z+0,495 (2)
a.x = 0,01 (3)
a.56y + a.16z = 2,52 (4)
Chia (4)/(3) \(\Rightarrow\dfrac{56y+16z}{x}=\dfrac{2,52}{0,01}\left(5\right)\)
Giải hệ (1), (2), (5)
(Cô giải ra mol bị lẻ \(x\approx0,0519;y\approx0,1975;z\approx0,1267\))
@Trần Hữu Tuyển @Hung nguyen @Nguyễn Thị Kiều @Hồ Hữu Phước
Các em xem lại xem cô sai ở đâu, cô ko phát hiện ra

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

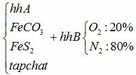
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
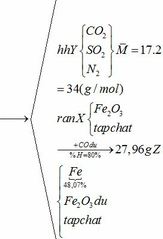
Vậy hỗn hợp Y gồm:
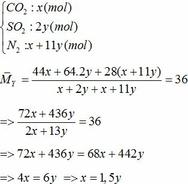
Khối lượng Fe có trong Z là:
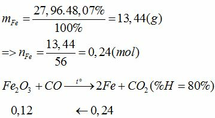
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
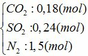
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
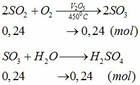
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
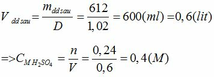

a.
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
nAl (dư, trong ½ phần) = 2/3.nH2 = 2/3.8,96/22,4 = 4/15 mol
nH2 = 26,88/22,4 = 1,2 mol
2Al + 6HCl = 3H2 + 2AlCl3
4/15..............0,4 mol
Fe + 2HCl = H2 + FeCl2
0,8..............0,8 mol
Phần không tan chỉ gồm Fe
Ta có : mFe = 44,8%m1 => m1 = m2 = 0,8.56.100/44,8 = 100g
b.
nFe (trong cả 2 phần) = 0,8.2 = 1,6 mol
2Al + Fe2O3 = Al2O3 + 2Fe
1,6....0,8.........0,8.........1,6 mol
=> mFe2O3 (ban đầu) = 0,8.160 = 128g
nAl (ban đầu) = nAl (ph.ư) + nAl (dư, trong 2 phần) = 1,6 + 2.4/15 = 32/15 mol
=> mAl (ban đầu) = 27.32/15 = 57,6g
sai rồi bạn ơi . 2 phần này có bằng nhau đâu mà làm theo kiểu v @@



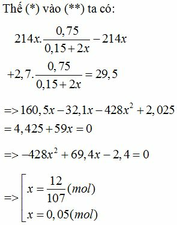
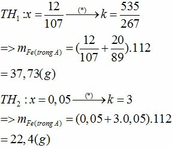
Nhiệt phân A hoàn toàn tạo ra B gồm Fe Al2O3 và Al dư
Xét phần 2
2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
Al2O3+2NaOH\(\rightarrow\)2NaAlO2+H2O
nH2=\(\frac{0,336}{22,4}\)=0,015(mol)
\(\rightarrow\)nAl=\(\frac{\text{0,015.2}}{3}\)=0,01(mol)
nFe=\(\frac{2,52}{56}\)=0,045(mol)
\(\rightarrow\) ne cho tối đa=0,01.3+0,045.3=0,165(mol)
Ta có nNO=\(\frac{3,696}{22,4}\)=0,165(mol)
\(\rightarrow\)ne nhận=0,165.3=0,495(mol)
Ta có
ne nhận(1)/ne cho(2)=3
\(\rightarrow\)Phần 1 gấp 3 lần phần 2
Xét phần 1
nAl=0,01.3=0,03(mol) nFe=0,045.3=0,135(mol)
\(\rightarrow\)nAl2O3=0,06(mol)
nO=0,06.3=0,18(mol)
x:y=nFe:nO=0,135:0,18=3:4
\(\rightarrow\)CTHH là Fe3O4
m=m phần 1+m phần 2=14,49+14,49.\(\frac{1}{3}\)=19,32(g)