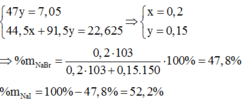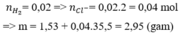Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2NaBr + Cl_2 \to 2NaCl + Br_2\\ 2NaI + Cl_2 \to 2NaCl + I_2\\ n_{Cl_2} =\dfrac{1}{2}n_{NaCl} = \dfrac{1}{2}.\dfrac{23,4}{58,5} = 0,2(mol)\\ \Rightarrow V_{Cl_2} = 0,2.22,4 = 4,48(lít)\)

nH2= 0,35(mol)
a) PTHH: Mg + 2 HCl -> MgCl2 + H2
x_________2x_______x______x(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
y________2y________y_____y(mol)
Ta có hpt: \(\left\{{}\begin{matrix}24x+56y=13,2\\x+y=0,35\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
b) m=m(muối khan)= mMgCl2 + mFeCl2= 95.x+127y=95.0,2+127.0,15= 38,05(g)
a)
Gọi
\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 13,2(1)\)
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Theo PTHH : \(n_{H_2} = a + b = 0,35(mol)\)(2)
Từ (1)(2) suy ra a = 0,15 ;b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,15.56}{13,2}.100\% = 63,64\%\\ \Rightarrow m_{Mg} = 100\% - 63,64\% = 36,36\%\)
b)
Ta có :\(n_{HCl} = 2n_{H_2} = 0,7(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 13,2 + 0,7.36,5 - 0,35.2=38,05(gam)\)

Sửa đề: đktc → đkc
a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: 24nMg + 56nFe = 13,2 (1)
\(n_{H_2}=\dfrac{8,6765}{24,79}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=0,35\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,2\left(mol\right)\\n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,2.24}{13,2}.100\%\approx36,36\%\\\%m_{Fe}\approx63,64\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
⇒ m muối khan = 0,2.95 + 0,15.127 = 38,05 (g)

Đáp án D
Nhận thấy ở hai thí nghiệm có lượng kim loại tham gia phản ứng như nhau, lượng HCl sử dụng lớn hơn lượng HCl sử dụng ở thí nghiệm 1 nhưng lượng H2 ở hai thí nghiệm thu được như nhau.
Do đó ở thí nghiệm 2 HCl phản ứng dư, thí nghiệm 1 có HCl phản ứng đủ hoặc dư.
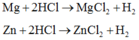
Có
![]()
Quan sát 4 đáp án nhận thấy chỉ có giá trị 0,3 là phù hợp.

\(n_{H_2}=\dfrac{0,336}{22,4}=0,015mol\)
\(\Rightarrow n_{HCl}=2n_{H_2}=2\cdot0,015=0,03mol\)
\(\Rightarrow n_{Cl^-}=0,03mol\Rightarrow m_{Cl^-}=1,065g\)
\(m_{CRắn}=m_{kl}+m_{Cl^-}=1,065+1,5=2,565g\)

\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}m_{Mg}=a\\n_{Fe}=b\end{matrix}\right.\) => 24a + 56b = 20
PTHH: Mg + 2HCl --> MgCl2 + H2
______a------------------>a------>a__________(mol)
Fe + 2HCl --> FeCl2 + H2
_b----------------->b----->b__________________(mol)
=> a+b = 0,5
=> \(\left\{{}\begin{matrix}a=0,25\\b=0,25\end{matrix}\right.\) => \(\left\{{}\begin{matrix}m_{MgCl_2}=0,25.95=23,75\left(g\right)\\m_{FeCl_2}=0,25.127=31,75\left(g\right)\end{matrix}\right.\) => m muối = 55,5(g)

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ: