Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

ý a là biết a=0,06 rồi biết b=6,975 à em? Mà a,b ở đâu vậy em?

a)
Do A và B đều là kim loại hóa trị II nên ta sử dụng phương pháp trung bình coi A và B là một chất gọi là X
=> CT chung của 2 muối là XCO3
Ta có nCO2 = \(\dfrac{1,12}{22,4}\) = 0,05 ( mol )
XCO3 + H2SO4 → XSO4 + H2O + CO2
0,05 <---- 0,05 <---0,05 <-- 0,05 < -0,05
bảo toàn khối lượng ta có
mXSO4 = mXCO3 + mH2SO4 - mH2O - mCO2
= 4,68 + ( 98 . 0,05 ) - ( 18 . 0,05 ) - ( 44 . 0,05 )
= 6,48 ( gam )
b) MXCO3 = mXCO3 : nXCO3 = 4,68 : 0,05 = 93,6
=> X = 93,6 - 12 - 16 . 3 = 33,6
có nACO3 : nBCO3 = 2 : 3
và nACO3 + nBCO3 = 0,05
=> nACO3 = 0,02 và nBCO3 = 0,03
=> nA = 0,02 và nB = 0,03
=> ( 0,02 . A + 5 : 3 . 0,03 . B) / 0,05 = 33,6
=> A = 24 ( là magie - Mg ) do B = A . 5 :3
=> B = 40 ( là canxi - Ca )
=> mMgCO3 = 1,68 ( gam )
=> %mMgCO3 = \(\dfrac{1,68}{4,68}\) . 100 \(\approx\) 36 %
=> %mCaCO3 = 100 - 36 = 64%

nHCl = 0,3.0,5 = 0,15 (mol) ; nCO2= 1,12 :22,4 = 0,05 (mol)
Khi nhỏ từ từ dd HCl vào dung dịch hỗn hợp NaHCO3 và Na2CO3 sẽ xảy ra phản ứng theo thứ tự:
HCl + Na2CO3 → NaHCO3 + NaCl (1)
HCl + NaHCO3 → CO2 + H2O (2)
Vì dung dịch X sau phản ứng + Ca(OH)2 dư thu được 20 gam kết tủa nữa => trong dd X có chứa NaHCO3 dư => HCl phản ứng hết
2NaHCO3 + Ca(OH)2 dư → CaCO3 + Na2CO3 + H2O (3)
0,4 ← 0,2 (mol)
nCaCO3 = 20 :100 = 0,2 (mol)
Từ PTHH (3) => nNaHCO3 dư = 2nCaCO3 = 0,4 (mol)
HCl+ Na2CO3 → NaHCO3 + NaCl (1)
(0,15 – 0,05) → 0,1 → 0,1 (mol)
HCl + NaHCO3 → CO2 + H2O (2)
0,05 ← 0,05 ← 0,05 (mol)
Từ PTHH (2): nHCl(2) = nNaHCO3(2) = nCO2 = 0,05 (mol)
=> nHCl(1) = ∑ nHCl – nHCl(2) = 0,15 – 0,05 = 0,1 (mol)
Từ PTHH (1): nNa2CO3 = nHCl = 0,1 (mol)
nNaHCO3(1) = nHCl(1) = 0,1 (mol)
Ta có: nNaHCO3(1) + nNaHCO3 bđ = nNaHCO3(2) + nNaHCO3 dư
=> nNaHCO3 bđ = 0,05 + 0,4 – 0,1 = 0,35 (mol)
=> a = mNa2CO3 + mNaHCO3 bđ = 0,1.106 + 0,35.84 = 40 (g)

Ta có: \(n_{K_2CO_3}=0,1.0,2=0,02\left(mol\right)\)
\(n_{KOH}=0,1.1,4=0,14\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{11,82}{197}=0,06\left(mol\right)\)
TH1: KOH dư.
Giả sử: nCO2 = x (mol)
\(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
x_________________x (mol)
⇒ ΣnK2CO3 = x + 0,02 (mol)
\(K_2CO_3+BaCl_2\rightarrow2KCl+BaCO_3\)
x + 0,02___________________x + 0,02 (mol)
⇒ x + 0,02 = 0,06 ⇔ x = 0,04 (mol)
⇒ VCO2 = 0,04.22,4 = 0,896 (l)
TH2: KOH hết.
\(BaCl_2+K_2CO_3\rightarrow2KCl+BaCO_3\)
_________0,06_____________0,06 (mol)
⇒ nK2CO3 (do CO2 pư tạo thành) = 0,06 - 0,02 = 0,04 (mol)
\(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
0,04___0,08_______0,04 (mol)
\(CO_2+KOH\rightarrow KHCO_3\)
0,06__(0,14-0,08) (mol)
⇒ nCO2 = 0,04 + 0,06 = 0,1 (mol)
⇒ VCO2 = 0,1.22,4 = 2,24 (l)
Bạn tham khảo nhé!





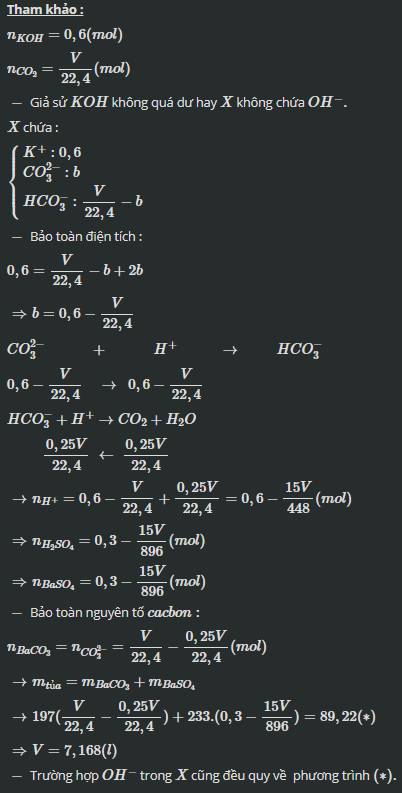


a)
$n_{CO_2} = 0,3(mol) ; n_{KOH} = 0,25.2 = 0,5(mol)$
Ta có :
$1< n_{KOH} : n_{CO_2} = 0,5 : 0,3 = 1,6<2$ Do đó, sản phẩm có $KHCO_3(a\ mol) ; K_2CO_3(b\ mol)$
$KOH + CO_2 \to KHCO_3$
$2KOH + CO_2 \to K_2CO_3 + H_2O$
Ta có :
$n_{KOH} = a + 2b = 0,5(mol)$
$n_{CO_2} = a + b = 0,3(mol)$
Suy ra: $a = 0,1 ; b = 0,2$
$m_{dd\ KOH} = D.V = 250.1,2 = 300(gam)$
$m_{dd\ X} = 300 + 0,3.44 = 313,2(gam)$
$C\%_{KHCO_3} = \dfrac{0,1.100}{313,2}.100\% =3,19\%$
$C\%_{K_2CO_3} = \dfrac{0,2.138}{313,2}.100\% = 8,81\%$
2)
$K_2CO_3 + BaCl_2 \to BaCO_3 + 2KCl$
$n_{BaCO_3} = n_{K_2CO_3} = 0,2(mol)$
$m_{BaCO_3} = 0,2.197 = 39,4(gam)$