Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài tập vận dụng
VD1: Hoà tan hoàn toàn 7,45 gam KCI vào 200ml H2O thu đưoc dung dịch A. Tính nồng độ %, nồng độ mol/l
của dung dịch A.
VD2: Hoà tan hoàn toàn 0,2 mol NaOH vào 500ml H20 thu được dung dịch B. Tính nồng độ %, nồng độ mol/l
của dung dịch B.
VD3: Hoà tan hoàn toàn 2,8 gam KOH và 5,85 gam NaCl vào 600 ml H2O thu được dung dịch C. Tinh nồng độ
%, nồng độ mol/l của dung dịch C.
VD4: Hoà tan hoàn toàn 4,6 gam Na vào 100 gam H20 thu được dung dịch D. Tính nồng độ %, nồng độ mol/I
của dung dịch D.
VD5: Hoà tan hoàn toàn 2,74 gam Ba vào 200 gam H2O thu được dung dịch E. Tính nồng độ %, nồng độ mol/l
của dung dịch E.
VD6: Hoà tan hoàn toàn 5,85 gam K và 13,7 gam Ba vào 400ml H2O thu đưoc dung dịch F. Tính nồng đo %,
nồng đo mol/l của dung dịch F.
VD1:
\(n_{KCl}=\dfrac{7,45}{74,5}=0,1\left(mol\right)\\ V_{ddKCl}=V_{H_2O}=200\left(ml\right)=0,2\left(l\right)\\ C_{MddKCl}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)

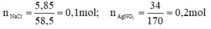
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 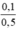 = 0,2 mol/l.
= 0,2 mol/l.

\(n_{KCl}=\dfrac{7,45}{74,5}=0,1\left(mol\right)\)
PTHH: 2KCl + 2H2O → 2KOH + H2 + Cl2
Mol: 0,1 0,1
mdd sau pứ = 7,45 + 200 = 207,45 (g)
\(C\%_{ddKOH}=\dfrac{0,1.56.100\%}{207,45}=2,7\%\)
Vdd sau pứ = 1.200 = 200 (ml) = 0,2 (l)
\(C_{M_{ddKOH}}=\dfrac{0,1}{0,1}=1M\)

\(1,n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ n_{NaOH}=1.0,3=0,3\left(mol\right)\)
\(T=\dfrac{0,3}{0,4}=0,75\rightarrow\)Tạo muối axit (NaHSO3) và SO2 dư
PTHH: NaOH + SO2 ---> NaHSO3
0,3------------------->0,3
\(C_{M\left(NaHSO_3\right)}=\dfrac{0,3}{0,3}=1M\)
\(2,n_{H_2S}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{NaOH}=0,2.2=0,4\left(mol\right)\)
\(T=\dfrac{0,4}{0,3}=\dfrac{4}{3}\rightarrow\)Tạo cả 2 muối (NaHS và Na2S)
PTHH:
2NaOH + H2S ---> Na2S + 2H2O
0,4--------->0,2------>0,2
Na2S + H2S ---> 2NaHS
0,1<------0,1------->0,2
\(\rightarrow\left\{{}\begin{matrix}C_{M\left(Na_2S\right)}=\dfrac{0,2-0,1}{0,2}=0,5M\\C_{M\left(NaHS\right)}=\dfrac{0,2}{0,2}=1M\end{matrix}\right.\)
1/ Số mol khí SO2 và NaOH lần lượt là 8,96:22,4=0,4 (mol) và 0,3.1=0,3 (mol). n\(OH^-\)/n\(SO_2\)=0,75<1, suy ra dung dịch thu được chỉ có muối NaHSO3 (0,3 mol).
Nồng độ mol cần tìm là CM \(\left(NaHSO_3\right)\)=0,3/0,3=1 (mol/l).
2/ Số mol khí H2S và NaOH là 6,72:22,4=0,3 (mol) và 0,2.2=0,4 (mol). n\(OH^-\)/n\(H_2S\)=4/3<2, suy ra dung dịch thu được chỉ có muối Na2S (0,2 mol).
Nồng độ mol cần tìm là CM \(\left(Na_2S\right)\)=0,2/0,2=1 (mol/l).

a)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
b)
PTHH: 2R + 2H2O --> 2ROH + H2
_____0,2<--------------0,2<----0,1
=> \(M_R=\dfrac{7,8}{0,2}=39\left(K\right)\)
c)
\(C_{M\left(KOH\right)}=\dfrac{0,2}{0,5}=0,4M\)

Đáp án D
nNaCl =0,1 mol, nAgNO3 = 0,2 mol
NaCl + AgNO3 → AgCl + NaNO3
0,1 → 0,1 0,1 (mol)
Vdd = 300 + 200 = 500 ml
![]() (dư) = 0,2 - 0,1 =0, 1 (mol)
(dư) = 0,2 - 0,1 =0, 1 (mol)
![]() = 0,1 mol
= 0,1 mol
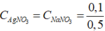 = 0,2 M
= 0,2 M

nAgNO3= 0,5x1= 0,5 mol
nHCl=0,3x2=0,6 mol
Pt AgNO3 + HCl = AgCl(kt) + HNO3
n 0,5 0,6
=> dung dịch sau phản ứng gồm HNO3 và HCl dư(AgCl kt nhé)
CM HNO3 = 0,5/(0,5+0,3) = 0,625M
CM HCl dư = (0,6-0,5)/(0,5+0,3) = 0,125M
mdd = 1,2x500 + 1,5x300 = 1050g
C% HNO3 = 3%
C% HCl=0,347%

nNaCl=0,2*1,5=0,3mol
Sau khi thêm nước thì nNaCl không đổi
Vdd mới= 0,2+0,3=0,5(l)
suy ra Cm NaCl=0,3/0,5=0,6M