Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = nCu = 0,15 mol
- Do thể tích dung dịch HNO3 cần dùng ít nhất → muối Fe2+ → ∑ ne cho = 2.(0,15 + 0,15) = 0,6 mol
- Theo đlbt mol electron nH+ = nHNO3 = (0,6.4)/3 = 0,8
→ VHNO3= 0,8 lít → đáp án C
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
0,15..0,6.........0,15 mol
2Fe{3+} + Cu = 2Fe{2+} + Cu{2+}
0,15.........0,075 mol
=> nCu (dư) = 0,15 - 0,075 = 0,075 mol
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
nHNO3 = 8/3nCu (dư) = 8/3.0,075 = 0,2 mol
=> ƩnHNO3 = 0,6 + 0,2 = 0,8 mol
=> VHNO3 = 0,8

A(Fe, S) ==nung==> B(Fe, S, FeS) ==HCl==> C(H2, H2S)
B(Fe, S, FeS) ==nung==> (Fe2O3, SO2)
Bằng phương pháp sơ đồ đường chéo bạn dễ dàng tính được tỉ lệ nH2/nH2S = 1/3
Mà nH2 + nH2S = V
=> nH2 = 0,25V và nH2S = 0,75V
Sau khi viết tất cả các phương trình phản ứng, bạn dễ dàng tính được những kết quả sau :
nFe (trong B) = nH2 = 0,25V mol => mFe = 14V g
nFeS (trong B) = nH2S = 0,75V mol => mFeS = 66V g
Phản ứng của B với O2 :
4FeS + 7O2 = 2Fe2O3 + 4SO2
0,75V....1,3125V mol
S + O2 = SO2
x.....x
Ta có 1,3125V + x = V'' => nS = x = V'' - 1,3125V
=> mS = 32V'' - 42V
mB = mFe + mS + mFeS = 14V + 32V'' - 42V + 66V = 38V + 32V'' g
b. nS = V'' - 1,3125V => V'' > 1,3125V => V''/V > 1,3125

Chọn C.
Quá trình cho e: Quá trình nhận e:
A l ∘ → A l + 3 + 3 e N + 5 + 3 e → N + 2
0,15 mol 0,45 mol 3x mol x mol
C u ∘ → C u + 2 + 2 e
0,15 mol 0,3 mol
Theo đinh luât bảo toàn mol e: ne (KL nhường) = ne (N nhận) = 0,75 mol
Hay: 3x = 0,75 ⇒ nNO = x = 0,25 mol
Và:
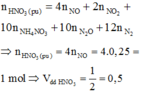

Đáp án C
Do HNO3 tối thiểu nên sản phẩm cuối cùng là muối Fe(NO3)2 và Cu(NO3)2
n N O = (0,15.2+0,15.2):3 = 0,2
n H N O 3 = 4 n N O = 0,8
=> V = 0,8 lít

Đáp án C
Để HNO3 ít nhất thì phản ứng chỉ
oxi hóa Fe à Fe2+
Bảo toàn e : 3nNO = 2nFe + 2nCu
=> nNO = 0,2 mol
=> nHNO3 = 4nNO = 0,8 mol
=> VHNO3 = 0,8 lit

Đáp án : C
Để HNO3 ít nhất thì phản ứng chỉ oxi hóa Fe Fe2+
Bảo toàn e : 3nNO = 2nFe + 2nCu => nNO = 0,2 mol
=> nHNO3 = 4nNO = 0,8 mol
=> VHNO3 = 0,8 lit