
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



HCHO có cấu tạo theo kiểu H-CO-H, cậu nhận thấy nó có 2 LK C-H; nên khi pư với Br2, nó điền thêm [O] vào các LK C-H đó; vấn đề là nó có thể điền vào 1 nhánh C-H hoặc cả hai nhánh
- Nếu chỉ điền vào một nhánh: tức pư với một phân tử Br2 ==> sp tạo thành là acid focmic:
H-COOH
- Nếu nó điền vào hai lần: tức pư với hai phân tử Br2 ==> sp tạo thành là:
HO-CO-OH = H2CO3 = H2O + CO2

nOH- = 0,04 mol
Vì nAlO2- = 0,02 mol mà chỉ thu được 0,01 mol kết tủa nên nHCl = 4n kết tủa + nAlO2- dư = 0,05 mol
=> tổng nH+ = 0,09 mol => V = 45ml
Vậy : B đúng
H+ + OH- => H2O 1
0,02......0,02
H+ + AlO2 - + H2O => Al(OH)3 2
0,02.....0,02.........................0,02
3H+ + Al(OH)3 => Al3+ +3H2O 3
0,03.........0,01
do cần V lớn nhất nên xét TH tạo kết tủa xong hòa tan 1 phần kết tủa
n Al(OH)3 =0,01 => nAl(OH)3 ở 3 =0,01
=> nHCl= 0,03 +0,02 +0,02 =0,07 => V=0,035 => C

Đáp án C
Định hướng tư duy giải
Giai đoạn 1: Tạo đến 102,6 gam kết tủa
là Ba(OH)2 chơi với (x mol) Al2(SO4)3
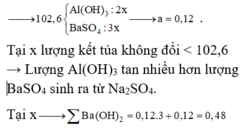

Đáp án C
Nhận thấy sau 1 thời gian mới bắt đầu xuất hiện kết tủa → chứng tỏ trong dung dịch chứa H+ dư
Dựa vào đồ thị tại 17a mol OH- kết tủa không đổi → chỉ chứa Mg(OH)2 : 2a mol → nMg= 2a mol
Lượng kết tủa cực đại chứa Mg(OH)2 : 2a mol, Al(OH)3 : 3a mol → nAl2O3 = 1,5a mol
→ 2a. 24+ 1,5a . 102 = 12, 06 → a = 0,06 mol
Gọi số mol của HCl và H2SO4 lần lượt là0,5b và 0,1b
Dung dịch X chứa Mg2+ : 0,12 mol, Al3+ : 0,18 mol, Cl-:0,5b mol, SO42- :0,1b mol H+ dư : 0,7b- 0,78 ( bảo toàn điện tích)
Tại thời điểm 17a mol OH- thì nOH- = 4nAl3+ + 2nMg2+ + nH+ dư → 17. 0,06 = 4. 0,18 + 2.0,12 + 0,7b- 0,78 → b = 1,2
Khi thêm :
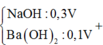


Kết tủa cực đại khi chưa ra sự hòa tan kết tủa thì nOH- = nH+ dư + 2nMg2+ + 3nAl3+ = 0,84
→ 0,5V = 0,84 → V = 1,68 lít → nBa2+ = 0,168 mol
Khi đó nBaSO4 = nSO42- = 0,12 mol
Chất rắn khan chứa BaSO4:0,12 mol; MgO: 0,12 mol; Al2O3: 0,09 mol → m = 41,94 gam

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Cho m gam hỗn hợp X gồm ( Fe , FeO , Fe2O3 ) có tỷ lệ khối lượng tương ứng là 7:18:40 .Hỗn hợp X tan vừa hết trong 500 ml H2SO4 loãng 0,68 M thu được dung dịch B và thoát ra V lít khí H2 ( đktc). Cho dung dịch B tác dụng NaOH dư lọc kết tủa nung khô trong không khí thu được 22,4 gam chất rắn. Giá trị của V là ?
A. 0,448
B. 0,896
C. 2,24
D. 1,12

Đáp án D
Căn cứ vào bản chất phản ứng và giả thiết, ta có đồ thị :
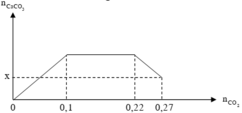
Nhìn vào đồ thị ta thấy :
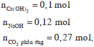
Ở thí nghiệm này kết tủa đã bị tan một phần.
Căn cứ vào dạng hình học của đề thí, suy ra : 0,1 - x = 0,27 - 0,22 => x = 0,05