Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{KMnO_4}=\dfrac{47,4}{158}=0,3\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4+ MnO2 + O2
0,3------------------------------>0,15
=> VO2 = 0,15.22,4 = 3,36 (l)
b)
\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
Xét tỉ lệ: \(\dfrac{0,1}{4}< \dfrac{0,15}{5}\) => P hết, O2 dư
PTHH: 4P + 5O2 --to--> 2P2O5
0,1------------>0,05
P2O5 + 3H2O --> 2H3PO4
0,05-------------->0,1
=> \(C_{M\left(H_3PO_4\right)}=\dfrac{0,1}{0,08}=1,25M\)
a)2KMnO4→K2MnO4+MnO2+O2nKMnO4=47,4158=0,3molnO2=nKMnO42=0,15molVO2=0,15×22,4=3,36lb)O2+4Na→2Na2ONa2O+H2O→2NaOHnNa=9,223=0,4mol0,44<0,151⇒O2 dưnNa2O=nNa2=0,2molnNaOH=2nNa2O=0,4molCMNaOH=0,40,2=2Mc)nNaOH=0,1×2=0,2molVNaOH=nCM=0,20,5=0,4l=400mla)2KMnO4→K2MnO4+MnO2+O2nKMnO4=47,4158=0,3molnO2=nKMnO42=0,15molVO2=0,15×22,4=3,36lb)O2+4Na→2Na2ONa2O+H2O→2NaOHnNa=9,223=0,4mol0,44<0,151⇒O2 dưnNa2O=nNa2=0,2molnNaOH=2nNa2O=0,4molCMNaOH=0,40,2=2Mc)nNaOH=0,1×2=0,2molVNaOH=nCM=0,20,5=0,4l=400ml
Cách tiến hành : Cho thêm 300ml nước vào dung dịch A

Hiện tượng Oxi kết hợp với Hemoglobin trong máu để biến máu đỏ sẫm thành máu đỏ tươi là: Phản ứng hóa học vì trong quá trình biến đổi chất này có tạo thành chất khác.
P/S: Phần in đậm là phần trả lời, phần còn lại mình giải thích thêm

\(n_P=\dfrac{9.3}{31}=0.3\left(mol\right)\)
\(4P+5O_2\underrightarrow{^{^{t^0}}}2P_2O_5\)
\(0.3.....0.375.....0.15\)
\(V_{O_2}=0.375\cdot22.4=8.4\left(l\right)\)
\(m_{P_2O_5}=0.15\cdot142=21.3\left(g\right)\)
PT: 4P + 5O2 → 2P2O5.
Ta có: nP= 9,3/31=0,3(mol)
Theo PT: nO2= 5/4 . nP=5/4 . 0,3=0,375(mol)
=> VO2=0,375.22,4=8,4(lít)
Theo PT: nP2O5=1/2 . nP=1/2 . 0,3=0,15(mol)
=> mP2O5= 0,15.142=21,3(g)

\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 2Cu + O2 --to--> 2CuO
0,1-------->0,2
=> mCuO = 0,2.80 = 16(g)

Gọi x,y là số mol của Al , Mg
a.2Al + 3H2SO4 ----> Al2(SO4)3 + 3H2
x _______________________ 3/2x
4Mg + 5H2SO4 ---> 4MgSO4 + H2
y______________________ 1/4y
b. Số mol của H2 là
\(^nh2=\)\(\dfrac{V}{22,4}\) = \(\dfrac{8,96}{22,4}\) = 0,4 (mol)
\(\dfrac{3}{2}\)x + \(\dfrac{1}{4}\)y = 0,4 ⇒ x = 0,195
27x + 24y =15,6 y= 0,43
\(^mAl=\) 0,195 . 27 = 5,265 (g)
\(^mMg=\) 0,43 . 24 = 10,32 (g)
%\(^mAl\) = \(\dfrac{5,256.100\%}{15,6}\)= 33,.75%
\(^{\%m}Mg=\)100% - 33,75% = 66,25%

Bài 3 :
vì nồng độ oxi trong ko khí loãng hơn so với trong khí oxi nguyên chất (tinh khiết)
Bài 4 :
sự cháy thì phát ra nhiệt và ánh sáng còn sự oxi hoá chậm chỉ phát ra nhiệt
Bài 5:
cần có đủ oxi và đủ điều kiện để tạo ra phản ứng gây cháy
Bài 6:
vì trọng lượng riêng (khối lượng riêng) của nước lớn hơn trọng lượng riêng (khối lượng riêng) của xăng dầu nên đám cháy sẽ lan ra

PTHH: 3Fe + 2O2 =(nhiệt)=> Fe3O4
a) nFe = 5,6 / 56 = 0,1 (mol)
\(\Rightarrow n_{O2}=\frac{0,1.2}{3}=\frac{1}{15}\left(mol\right)\)
Thể tích oxi cần dùng ở điều kiện tiêu chuẩn là:
=> VO2(đktc) = \(\frac{1}{15}.22,4\approx1,5\left(lit\right)\)
b) nFe3O4 = \(\frac{0,1}{3}=\frac{1}{30}\left(mol\right)\)
=> mFe3O4 = \(\frac{1}{30}.232\approx7,73\left(gam\right)\)

nP = 15,5 : 31= 0,5 (mol )
nO2 = (56 : 22,4 ) . 21% = 0,525 (mol )
pthh : 4P+5O2-t--> 2P2O5
LTL
0,5 / 4 > 0,525/5 => P dư
theo pthh , nP2O5 = nO2 = 0,525 (mol)
=> mP2O5 = 0,525 . 142 = 74,55 (g)
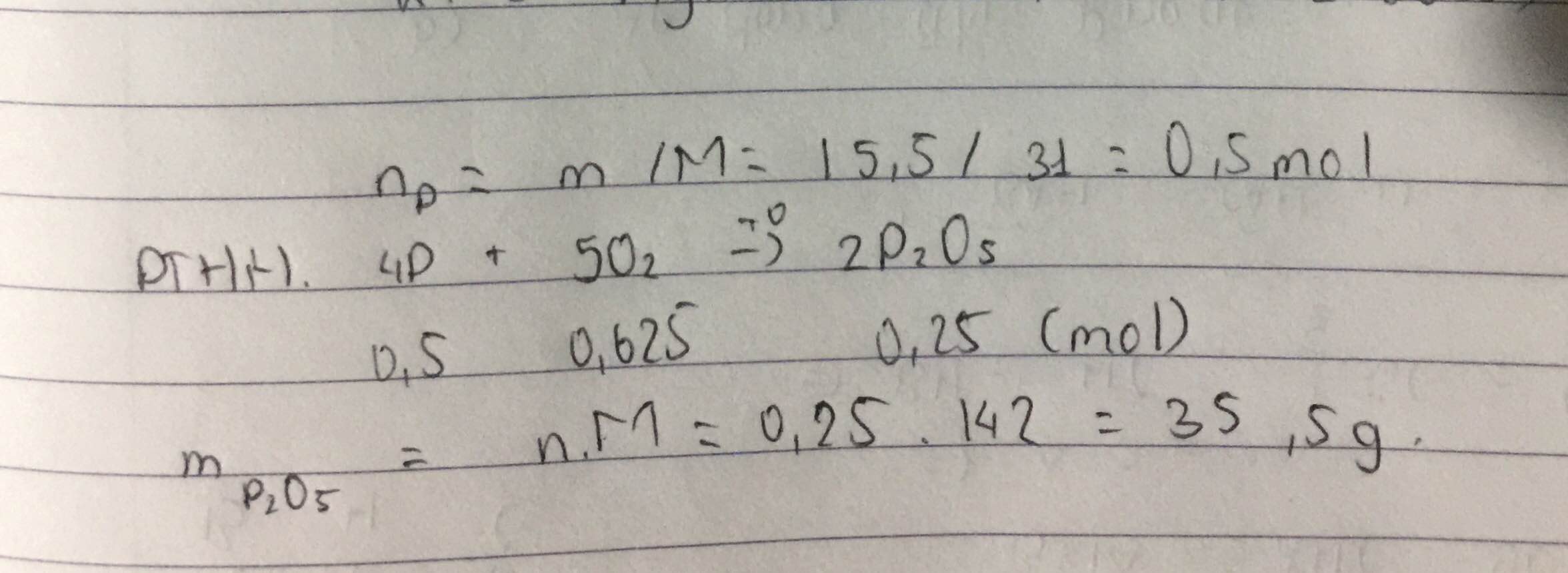
Cháy là phản ứng oxy hóa - khử nhiệt độ cao giữa một chất đốt và tác nhân oxy hóa, thường là oxy khí quyển, tạo ra các sản phẩm oxy hóa thường dạng hơi, trong một hỗn hợp gọi là khói. Sự cháy tạo ra ngọn lửa, và tạo ra nhiệt độ đủ cho sự cháy tự duy trì.
Cháy là phản ứng oxy hóa - khử nhiệt độ cao giữa một chất đốt và tác nhân oxy hóa, thường là oxy khí quyển, tạo ra các sản phẩm oxy hóa thường dạng hơi, trong một hỗn hợp gọi là khói.
Vai trò: Sự cháy tạo ra ngọn lửa, và tạo ra nhiệt độ đủ cho sự cháy tự duy trì.