Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo gt ta có: $n_{Al}=0,3(mol)$
Gọi số mol $NO$ và $NO_2$ lần lượt là 0,4a và 0,6a
a, Bảo toàn e ta có: $0,4a.3+0,6a=0,9$
$\Rightarrow a=0,5\Rightarrow V=1,12(l)$
b, Dùng phương trình $H^+$ ta có: $n_{HNO_3}=1,4(mol)$
$\Rightarrow \%C_{HNO_3}=700(g)$

a)\(n_{Zn}=\dfrac{16,25}{65}=0,25mol\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,25 0,25 0,25 0,25
b)\(V_{H_2}=0,25\cdot22,4=5,6l\)
\(m_{Zn}=0,25\cdot65=16,25g\)
Dẫn toàn bộ \(0,25molH_2\) qua \(CuO\):
\(n_{CuO}=\dfrac{36}{80}=0,45mol\)
c)\(CuO+H_2\rightarrow Cu+H_2O\)
0,45 0,45
\(m_{Cu}=0,45\cdot64=28,8g\)

a) nFe=0,4(mol); nH2SO4=0,5(mol)
PTHH: Fe + H2SO4 -> FeSO4 + H2
Ta có: 0,4/1 < 0,5/1
=> Fe hết, H2SO4 dư. tính theo nFe.
=> nH2= nH2SO4(p.ứ)=nFe=0,4(mol)
=>nH2SO4(dư)=0,5-0,4=0,1(mol)
=>H2SO4(dư)=0,1.98=9,8(g)
b) V(H2,dktc)=0,4.22,4=8,96(l)

Câu 1:
Ta có: \(n_{H_2SO_4}=0,25.1=0,25\left(mol\right)\)
PT: \(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+CO_2\)
\(CaCO_3+H_2SO_4\rightarrow CaSO_4+H_2O+CO_2\)
\(MgCO_3+H_2SO_4\rightarrow MgSO_4+H_2O+CO_2\)
Theo PT, có: \(n_{H_2O}=n_{CO_2}=n_{H_2SO_4}=0,25\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,25.22,4=5,6\left(l\right)\)
Theo ĐLBT KL, có: mhh + mH2SO4 = m muối + mH2O + mCO2
⇒ m muối = mhh + mH2SO4 - mH2O - mCO2
= 25,2 + 0,25.98 - 0,25.18 - 0,25.44
= 34,2 (g)
Bạn tham khảo nhé!
Câu 2:
Ta có: \(n_{H_2SO_4}=0,5\cdot0,75=0,375\left(mol\right)=n_{H_2O}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{H_2SO_4}=0,375\cdot98=36,75\left(g\right)\\m_{H_2O}=0,375\cdot18=6,75\left(g\right)\end{matrix}\right.\)
Bảo toàn khối lượng: \(m_{oxit}=m_{muối}+m_{H_2O}-m_{H_2SO_4}=28,5\left(g\right)\)

$a\big)2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2$
$b\big)$
$n_{Al}=\dfrac{4,05}{27}=0,15(mol)$
$n_{H_2SO_4}=\dfrac{29,4}{98}=0,3(mol)$
Vì $\dfrac{n_{Al}}{2}<\frac{n_{H_2SO_4}}{3}\to H_2SO_4$ dư
$c\big)$
Theo PT: $n_{H_2}=\dfrac{3}{2}n_{Al}=0,225(mol)$
$\to V_{H_2}=0,225.22,4=5,04(l)$
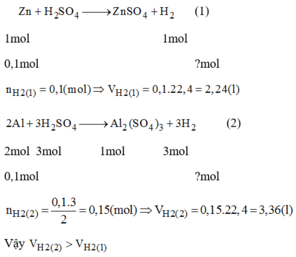
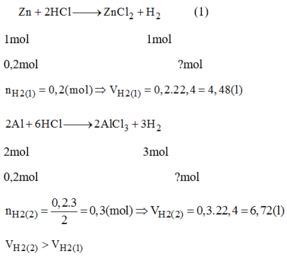
TH1: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,1 -----------------------------> 0,1 (mol)
=> \(V_{H_2}\)= 0,1 . 22,4 = 2,24(lít)
TH2: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO4\right)_3+3H_2\)
0,1 ------------------------------------> 0,15 (mol)
\(\Rightarrow V_{H_2}\)=0,15 . 22,4 = 3,36 (lít)
Ta thấy 2,24 < 3,36
\(\Rightarrow V_{H_2\left(TH1\right)}< V_{H_2\left(TH2\right)}\)