Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
(c) Tan nhiều trong nước;
(d) Nặng hơn oxi;
(e) Kém bền, dễ bị phân hủy thành nitơ nguyên tử

Gọi số hạt proton, nơtron, electron tương ứng là: P, N, Z (trong một nguyên tử, số hạt proton = số hạt electron, do đó: P = Z).
Số hạt mang điện nhiều hơn số hạt không mang điện là 10 nên: 2Z - N = 10 (1).
Số N chiếm 35,294% tổng số hạt, nên: N = 0,35294(2Z + N) (2).
Giải hệ (1) và (2) ta được: Z = 11 và N = 12
a) kí hiệu nguyên tử X là: \(^{23}_{11}Na\)
b) Từ kết quả câu a, nên hợp chất M có công thức chung: NaaYb.
Tổng số proton trong hợp chất M là: 11a + P.b = 30 (3). Tổng số nguyên tử trong hợp chất M là: a + b = 3 (4).
Vì 1 \(\le\) a,b \(\le\) 2, và a,b \(\in\) N (số nguyên dương), do đó: a = 1, b = 2 hoặc a = 2, b = 1.
Thay 2 cặp nghiệm trên vào (3), ta thấy chỉ có trường hợp P = 8 (số proton của nguyên tử O) là hợp lí.
Do đó công thức của M là: Na2O.

Phân tử khối của Bari hidroxit là:
Ba\(\left(OH\right)_2\)= 137 + (16x2+1)
= 137 + 33
= 170
Phân tử khối của Lưu huỳnh đioxit là:
SO2 = 32 + (16x2)
= 32 + 32
= 64

a) Este là sản phẩm của phản ứng giữa axit và ancol. S
b) Este là hợp chất hữu cơ trong phân tử có nhóm COO– . S
c) Este no, đơn chức, mạch hở có công thức phân tử CnH2nO2, với n ≥ 2. Đ
d) Hợp chất CH3COOC2H5 thuộc loại este. Đ
e) Săn phẩm của phản ứng giữa axit và ancol là este. S
Bài 2 :
CH3 – CH2 – COO – CH3
CH2 – COO – CH2 – CH3
HCOO – CH2 – CH2 – CH3


PTK:
a) Khí clo Cl2=35,5.2=71đvC
b) Axit sunfuric: H2SO4=98đvC
c) Kali pemanganat KMnO4:158 đvC
Proton : kí hiệu p, mang điện tích dương * Nơ tron : kí hiệu n,không mang điện tích * Electron : kí hiệu e, mang điện tích âm
nó trung hòa vì điện vì trong nó vừa có điện tích âm và điện tích dương
PTk: bari hidroxit: Ba(OH)2 171đvC
SO2: 64ĐvC
- Phân tử oxi nặng hơn phân tử nước 1,1778 (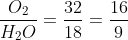 ) lần
) lần
- Phân tử oxi nhẹ hơn phân tử muối ăn và bằng 0,55 lần.
(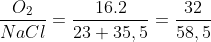 = 0,55)
= 0,55)
- Phân tử oxi nặng hơn phân tử khí metan 2 lần.