Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{dd.H_2SO_4}=51,5.1,84=94,76\left(g\right)\)
\(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 6H2SO4 --> Al2(SO4)3 + 3SO2 + 6H2O
0,2<----0,6<--------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
=> \(n_{Fe_2O_3}=\dfrac{21,4-5,4}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
0,1--->0,3
=> \(m_{H_2SO_4\left(lý.thuyết\right)}=\left(0,6+0,3\right).98=88,2\left(g\right)\)
=> \(m_{H_2SO_4\left(tt\right)}=88,2.105\%=92,61\left(g\right)\)
=> \(C\%=\dfrac{92,61}{94,76}.100\%=97,7\%\)

Đáp án A
Gọi số mol các kim loại là Al: a mol; Fe: b mol.
Ta có:
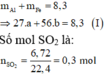
Sơ đồ phản ứng:
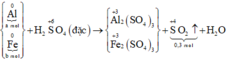
Các quá trình nhường, nhận electron:


Chọn C
C a C O 3 + H 2 S O 4 ( l o ã n g ) → C a S O 4 + C O 2 + H 2 O
C a C O 3 + H 2 S O 4 ( đ ặ c ) → C a S O 4 + C O 2 + H 2 O

\(n_{H_2}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + H2SO4 ---> FeSO4 + H2
a------------------------------>a
Zn + H2SO4 ---> ZnSO4 + H2
b---------------------------->b
\(\Rightarrow\left\{{}\begin{matrix}56a+65b=2,14\\a+b=0,035\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,015\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
PTHH:
2Fe + 6H2SO4(đ, n) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,015--------------------------------------->0,0225
Zn + 2H2SO4(đ, n) ---> ZnSO4 + SO2 + 2H2O
0,02---------------------------------->0,02
=> VSO2 = (0,0225 + 0,02).22,4 = 0,952 (l)

Đáp án D
Sơ đồ phản ứng:
X ⏟ 1 mol Y ⏟ 1 mol + H 2 S + 6 O 4 ( đ ặ c ) → t 0 F e + 3 2 ( SO 4 ) 3 + S + 4 O 2 ⏟ 2 mol + H 2 O
Các quá trình nhường electron đối với Fe và hợp chất của sắt:
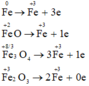
Gọi M là chất chung cho X, Y và k là số electron trao đổi của M trong phản ứng
![]()
Các quá trình nhường, nhận electron:
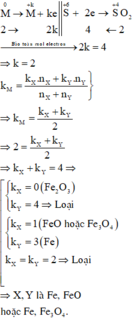

a, \(Fe+H_2SO_{4\text{loãng}}\rightarrow FeSO_4+H_2\)
\(n_{Fe}=n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(Fe+H_2SO_{4\text{đặc}}\rightarrow Fe_2\left(SO_4\right)_3+SO_2+H_2O\)
\(Cu+H_2SO_{4\text{đặc}}\rightarrow CuSO_4+SO_2+H_2O\)
Bảo toàn e:
\(2n_{Cu}+3n_{Fe}=2n_{SO_2}\)
\(\Leftrightarrow n_{Cu}=\dfrac{2n_{SO_2}-3n_{Fe}}{2}=0,25\left(mol\right)\)
\(\Rightarrow x=m_{Cu}+m_{Fe}=0,25.64+0,5.56=44\left(g\right)\)
a) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)=b=n_{Fe}\\n_{SO_2}=\dfrac{22,4}{22,4}=1\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(2a+3b=2\) \(\Rightarrow2a+3\cdot0,5=2\) \(\Rightarrow a=n_{Cu}=0,25\left(mol\right)\)
\(\Rightarrow x=m_{Cu}+m_{Fe}=0,25\cdot64+0,5\cdot56=44\left(g\right)\)
b) Ta có: \(n_{H_2SO_4\left(p/ư\right)}=\dfrac{1}{2}n_{e\left(traođổi\right)}+n_{SO_2}=\dfrac{1}{2}\cdot2+1=2\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2SO_4\left(đặc\right)}=2\cdot110\%=2,2\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{2,2\cdot98}{98\%}=220\left(g\right)\) \(\Rightarrow V_{H_2SO_4}=\dfrac{220}{1,84}\approx119,57\left(ml\right)\)
c) Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=1\left(mol\right)\\n_{Ba\left(OH\right)_2}=0,4\cdot1,5=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo 2 muối
PTHH: \(2SO_2+Ba\left(OH\right)_2\rightarrow Ba\left(HSO_3\right)_2\)
2x x x (mol)
\(SO_2+Ba\left(OH\right)_2\rightarrow BaSO_3\downarrow+H_2O\)
y y (mol)
Ta lập được hệ phương trình: \(\left\{{}\begin{matrix}x+y=0,6\\2x+y=1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=n_{Ba\left(HSO_3\right)_2}=0,4\left(mol\right)\\y=0,2\end{matrix}\right.\)
\(\Rightarrow C_{M_{Ba\left(HSO_3\right)_2}}=\dfrac{0,4}{0,4}=1\left(M\right)\)

- 1 lượng Fe lần lượt tác dụng hết với axit sunfuric loãng, dư và axit sunfuric đặc nóng, dư
Fe + H2SO4 => FeSO4 + H2
1___________1_____________
2Fe + 6H2SO4 => Fe2(SO4)3 + 3SO2 + 6H2O
1_______________1,5________________
=> nH2 < nSO2
Nên lượng khí sinh ra khi cho Fe tác dụng với H2SO4 đặc nóng lớn hơn khi cho Fe tác dụng vs H2SO4 loãng