Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
![]()
· Phần 1 + NaOH → 0,75 mol H2
=> Al dư, Fe2O3 phản ứng hết.
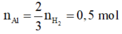
· Đặt số mol Fe, A l 2 O 3 trong phần 1 lần lượt là 2x, x.
Giả sử phần 2 có khối lượng gấp k lần phần 1.
![]() (1)
(1)
Phần 2:
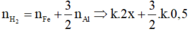
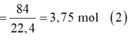
· Từ (1) và (2) suy ra:
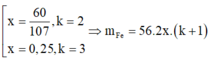
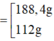
Kết hợp đáp án suy ra m F e = 112 g

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
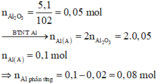
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
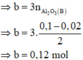
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
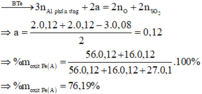

B gồm 3 kim loại là Fe, Cu, Ag
\(n_{H_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,03<----------------0,03
Gọi số mol Cu, Ag là a, b (mol)
=> 64a + 108b = 8,12 - 0,03.56 = 6,44 (g) (1)
\(\left\{{}\begin{matrix}n_{Al^{3+}}=\dfrac{0,81}{27}=0,03\left(mol\right)\\n_{Fe^{2+}}=\dfrac{2,8}{56}-0,03=0,02\left(mol\right)\end{matrix}\right.\)
=> \(n_{NO_3^-}=0,03.3+0,02.2=0,13\left(mol\right)\)
\(\left\{{}\begin{matrix}n_{Cu\left(NO_3\right)_2}=a\left(mol\right)\\n_{AgNO_3}=b\left(mol\right)\end{matrix}\right.\)
=> 2a + b = 0,13 (2)
(1)(2) => a = 0,05 (mol); b = 0,03 (mol)
=> \(C_{M\left(Cu\left(NO_3\right)_2\right)}=\dfrac{0,05}{0,1}=0,5M\)

Đáp án A
Ta có sơ đồ phản ứng:
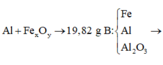
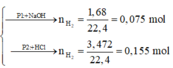
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
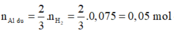
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
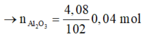
Ta có:
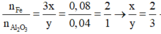
=> Oxit sắt cần tìm là Fe2O3
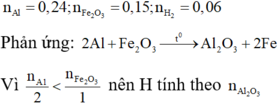


Đáp án D
8 Al + 3 Fe 3 O 4 → t o 4 Al 2 O 3 + 9 Fe
Khối lượng nhôm giảm chính là khối lượng nhôm đã tham gia phản ứng.
⇒ n Al phan ung = 0 , 81 27 = 0 , 03 ⇒ n Fe 3 O 4 = 3 8 n Al phan ung = 0 , 01125
Vì A tác dụng với dung dịch NaOH có H2 nên A có chứa Al dư và