
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài giải:
Nguyên liệu là lưu huỳnh(hoặc quặng pirit), không khí và nước
- sản xuất SO2 bằng cách đốt S trong không khí
S + O2 ----> SO2
- sản suất SO3 bằng cách oxi hóa SO2( chất xúc tác là V2O5 ở nhiệt độ 450 độ C)
2SO2 + O2 -----> 2SO3
- sản xuất H2SO4 bằng cách cho SO3 t/d với H2O
SO3 + H2O ----> H2SO4
- Nguyên liệu là lưu huỳnh (hoặc quặng pirit ) , không khí và nước .
- Sản xuất :
+ Sản xuất lưu huỳnh đioxit bằng cách đốt lưu huỳnh trong không khí
S + O \(\rightarrow\) SO2
+ Sản suất Slưu huỳnh trioxit bằng cách oxi hóa lưu huỳnh đioxit ( chất xúc tác là Vannađi ( V ) oxit ở 450 độ C)
\(SO_2+\dfrac{1}{2}O_2\rightarrow SO_3\)
+ Sản xuất axit sunfuric bằng cách cho lưu huỳnh đioxit tác dụng với nước .
\(SO_3+H_2O\rightarrow H_2SO_4\)

Thành phần chính của thuốc muối là natri hiđrôcacbonat, CTHH: NaHCO3. Trong dạ dày thường chứa dung dịch axit. Người bị đau dạ dày là người có nồng độ dung dịch axit HCl cao làm dạ dày bị bào mòn. NaHCO3 dùng để làm thuốc trị đau dạ dày vì nó làm giảm hàm lượng dung dịch HCl có trong dạ dày nhờ có phản ứng hóa học.
NaHCO3 + HCl → NaCl + CO2 + H2O
Thành phần chính của thuốc muối nabica là natri hidrocacbonat (NaHCO3).
Cơ chế hoạt động của thuốc: Trong dạ dày có 1 lượng axit HCl giúp hòa tan các loại muối khó tan trong quá trình ăn uống. Khi axit dạ dày tăng cao, nếu uống thuốc muối nabica thì NaHCO3 trong thuốc muối tác dụng với axit HCl trong dạ dày theo phương trình hóa học:
NaHCO3 + HCl \(\rightarrow\) NaCl + CO2\(\uparrow\) + H2O.
Lượng axit thừa trong dạ dày đã tác dụng với NaHCO3 có trong thuốc muối nabica, do vậy không còn, nhờ vậy người bị ợ chua, thừa axit không còn bị như vậy nữa.

Số trường hợp xuất hiện ăn mòn điện hoá là 2
CuCl2 và HCl có lẫn CuCl2.
Trong dung dịch có Fe và Cu cùng tiếp xúc với dung dịch chất điện li Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu

\(m_{Cl}=75,97-29,89=46,08\)
\(n_{Na}=\frac{29,89}{22,99}\approx1,3\)
\(n_{Na}=n_{Cl}=1,3\)
\(\Rightarrow M_{Cl}=\frac{46,08}{1,3}=35,44\).

E là este no, đơn chức => E được tạo thành từ 1 axit cacboxylic no, đơn chức, mạch hở và 1 ancol no, đơn chức, mạch hở.
từ X điều chế trực tiếp ra Y bằng một phản ứng => E là CH3COOC2H5.
PTPỨ:
CH3COOC2H5 + H2O => CH3COOH(Y) + C2H5OH(X)
C2H5OH + O2 (men giấm)=> CH3COOH + H2O

80 tấn quặng pirit chứa 40% S
m.S = 40 . 80 : 100 = 32 tấn S
theo lí thuyết 32 tấn S sẽ tạo ra đc 98 tấn H2SO4
thực tế chỉ tạo ra 73,5 tấn
Hiệu suất là H = 73,5/98 x 100% =75%
Khối lượng dung dịch H2S04 50% có là 73,5 . 100/50 = 147 (g)

Thành phần chính của xi măng là CaSiO3, Ca(AlO2)2
Sản xuất xi măng cần những nguyên liệu: đất sét, đá vôi, cát…
– Công đoạn: Nghiền nhỏ đá vôi và đất sét rồi trộn đều với cát, nước thành dạng bùn
– Nung hỗn hợp trong lò quay ở nhiệt độ 1400 – 1500 độ C tạo clanhke rắn
– Nghiền clanhke và phụ gia thành bột mịn là xi măng
Bài 3. Thành phần chính của xi măng là gì ? Cho biết nguyên liệu chính và mô tả sơ lược các công đoạn sản xuất xi măng.
Thành phần chính của xi măng là CaSiO3, Ca(AlO2)2
Sản xuất xi măng cần những nguyên liệu: đất sét, đá vôi, cát…
– Công đoạn: Nghiền nhỏ đá vôi và đất sét rồi trộn đều với cát, nước thành dạng bùn
– Nung hỗn hợp trong lò quay ở nhiệt độ 1400 – 1500 độ C tạo clanhke rắn
– Nghiền clanhke và phụ gia thành bột mịn là xi măng

Ta có:
\(V_{C2H5OH}=4,6.14\%=0,644\left(l\right)=644\left(ml\right)\)
\(\Rightarrow m_{C2H5OH}=0,8.644=515,2\left(g\right)\)
\(\Rightarrow n_{C2H5OH}=\frac{515,2}{46}=11,2\left(mol\right)\)
\(V_{H2O}=4,6-0,644=3,956\left(l\right)=3956\left(ml\right)\)
\(\Rightarrow m_{H2O}=3956\left(g\right)\)
Mà H = 30%
\(\Rightarrow n_{C2H5OH\left(pư\right)}=11,2.30\%=3,36\left(mol\right)\)
\(C_2H_5OH+O_2\underrightarrow{^{men.giam}}CH_3COOH+H_2O\)
\(\Rightarrow n_{O2}=n_{CH3COOH}=3,36\left(mol\right)\)
\(m_{dd\left(spu\right)}=515,2+3956+3,36.32=4578,72\left(g\right)\)
\(\Rightarrow C\%_{CH3COOH}=\frac{3,36.60}{4578,72}.100\%=4,4\%\)

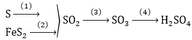


Đáp án A