Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
- K2Cr2O7: Gọi số oxi hóa của Cr trong K2Cr2O7 là x
=> (+1).2 + x.2 + (-2).7 = 0
=> x = +6
=> Số oxi hóa của Cr trong K2Cr2O7 là +6
- KMnO4: Gọi số oxi hóa của Mn trong KMnO4 là x
=> (+1).1 + x.1 + (-2).4 = 0
=> x = +7
=> Số oxi hóa của Mn trong KMnO4 là +7
- KClO4: Gọi số oxi hóa của Cl trong KClO4 là x
=> (+1).1 + x.1 + (-2).4 = 0
=> x = +7
=> Số oxi hóa của Cl trong KClO4 là +7
- NH4NO3: Gọi số oxi hóa của N cần tìm là x
=> x.1 + (+1).1 + (+5).1 + (-2).3 = 0
=> x = -3
=> Số oxi hóa của N cần tìm trong NH4NO3 là -3
b)
- AlO2-: Gọi số oxi hóa của Al trong AlO2- là x
=> x.1 + (-2).2 = -1
=> x = +3
=> Aố oxi hóa của Al trong AlO2- là +3
- PO43-: Gọi số oxi hóa của P trong PO43- là x
=> x.1 + (-2).4 = -3
=> x = +5
=> Số oxi hóa của P trong PO43- là +5
- ClO3-: Gọi số oxi hóa của Cl trong ClO3- là x
=> x.1 + (-2).3 = -1
=> x = +5
=> Số oxi hóa của Cl trong ClO3- là +5
- SO42-: Gọi số oxi hóa của S trong SO42- là x
=> x.1 + (-2).4 = -2
=> x = +6
=> Số oxi hóa của S trong SO42- là +6

- Nồng độ chất phản ứng giảm dần theo thời gian
- Nồng độ chất sản phẩm tăng dần theo thời gian

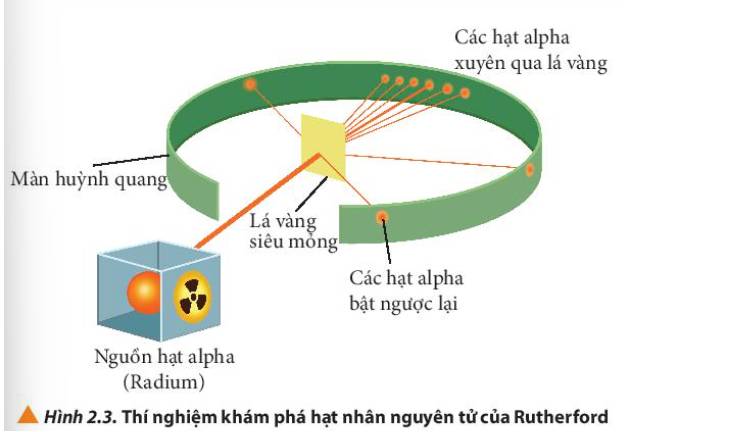
- Quan sát Hình 2.3 thấy được: hầu hết các hạt α đi thẳng, có vài hạt bị bắn theo đường gấp khúc
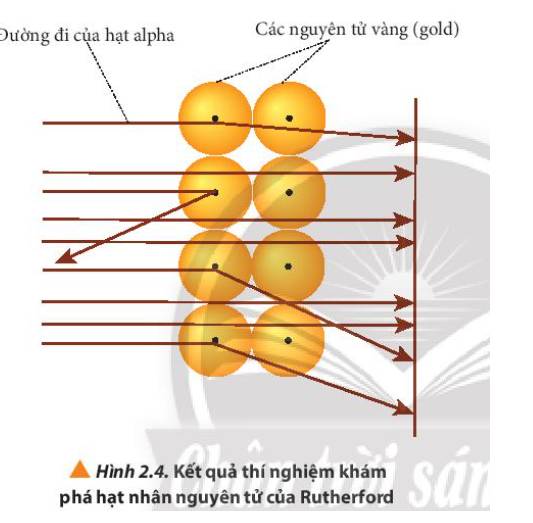
- Quan sát Hình 2.4 giải thích: các hạt α bị bắn theo đường gấp khúc là do va vào hạt nhân của nguyên tử vàng, các hạt không va vào hạt nhân thì đi thẳng
- Các hạt alpha hầu hết đều xuyên thẳng qua lá vàng, một số ít bị lệch hướng và một số rất ít bị bật ngược lại.
Giải thích: Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.

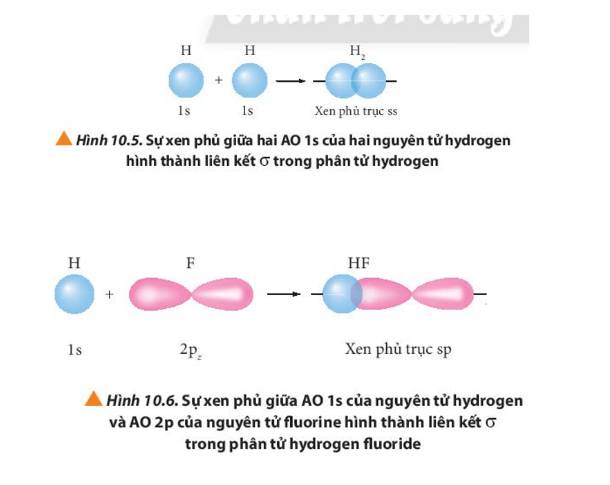
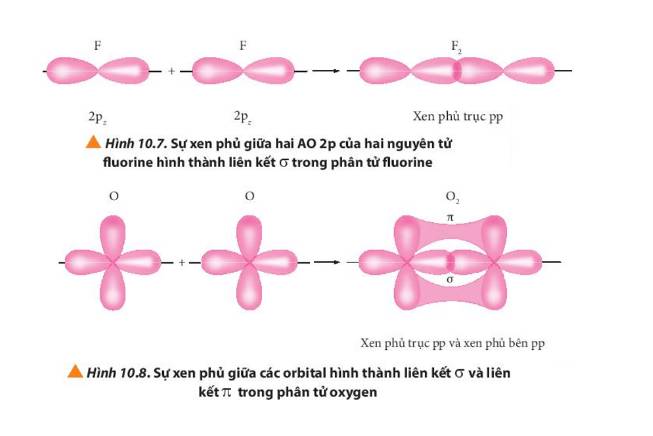
- Liên kết σ trong mỗi phân tử được tạo thành bởi sự xen phủ trục
- Liên kết п trong mỗi phân tử được tạo thành bởi sự xen phủ bên

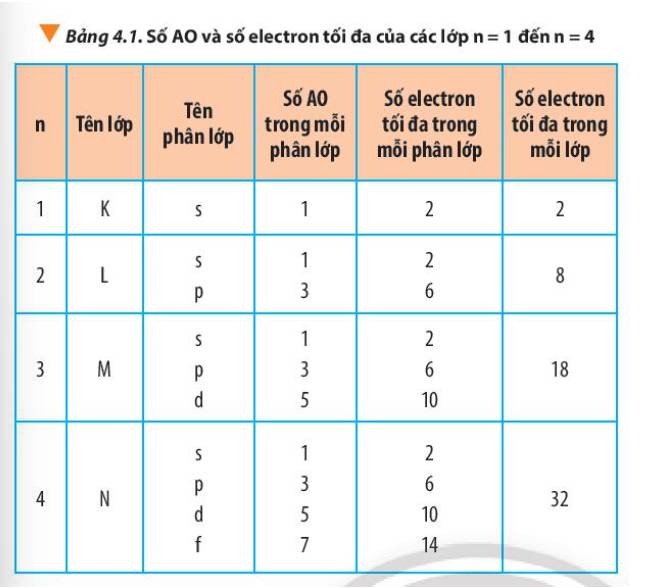
- Lớp 1 có tối đa 2 electron = 2.12
- Lớp 2 có tối đa 8 electron = 2.22
- Lớp 3 có tối đa 18 electron = 2.32
- Lớp 4 có tối đa 32 electron = 2.42
=> Số electron tối đa trong lớp n là 2n2

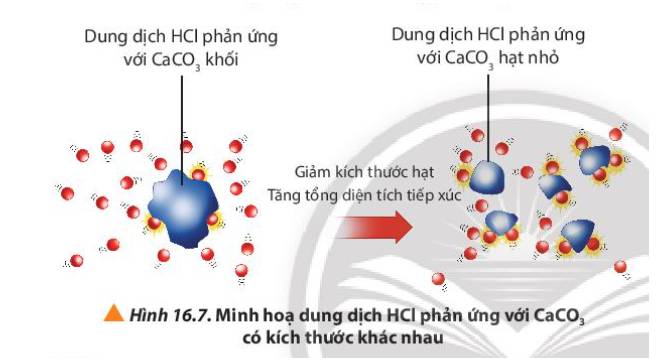
- Ở bình 2, CaCO3 ở dạng hạt nhỏ
=> Tổng diện tích tiếp xúc giữa CaCO3 với HCl tăng
=> Tốc độ phản ứng bình 2 tăng
=> Tốc độ khí thoát ra ở bình 2 nhanh hơn
CaCO3 có kích thước nhỏ sẽ có bề mặt tiếp xúc với dung dịch HCl lớn hơn so với CaCO3 kích thước lớn (cùng khối lượng), làm tăng tần số va chạm giữa các chất phản ứng, dẫn đến tốc độ phản ứng tăng.

Fe2O3 + 2Al → 2Fe + Al2O3
Phản ứng làm tăng nhiệt độ môi trường xung quanh, tỏa nhiệt lớn, lên đến 2500 oC

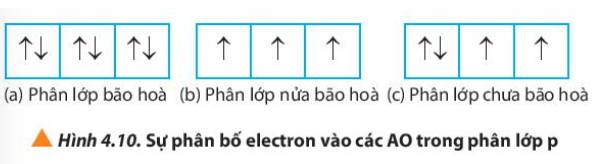
(a) Phân lớp bão hòa => Không có electron độc thân
(b) Phân lớp nửa bão hòa => Số electron độc thân = số orbital của phân lớp đó
(c) Phân lớp chưa bão hòa => số electron độc thân nhỏ hơn số orbital trong phân lớp đó
Trường hợp a) không có electron độc thân
Trường hợp b) có 3 electron độc thân
Trường hợp hợp c) có 2 electron độc thân
Nhận xét:
Phân lớp bão hòa chứa đủ số electron tối đa.
Phân lớp nửa bão hòa chứa một nửa số electron tối đa.
Phân lớp chưa bão hòa chưa đủ số electron tối đa.




(a) – Lá nhôm: Al ⇒ Chỉ có 1 nguyên tố Al ⇒ Đơn chất
(b) – Bình khí nitrogen: N2 ⇒ Chỉ có 1 nguyên tố N ⇒ Đơn chất
(c) – Cốc nước: H2O ⇒ Có 2 nguyên tố là H và O ⇒ Hợp chất
(d) – Muối ăn: NaCl ⇒ Có 2 nguyên tố là Na và Cl ⇒ Hợp chất