

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Tham khảo:
a) 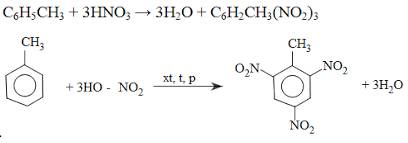
b) PTHH :
C6H5CH3 + 3HNO3 → C6H2(NO2)3CH3 + 3H2O
gam 92 227
kg 1000.62% x
Từ 1 tấn toluene có thể điều chế được số kilôgam 2,4,6-trinitrotoluene, biết hiệu suất của phản ứng là 62% là:
x = 1000*0,62.227 : 92 = 1530 kg

CH3CH2CH2OH \(\underrightarrow{H_2SO_{4đ}}\) CH3CH=CH2 + H2O
CH3CH(OH)CH3 \(\underrightarrow{H_2SO_{4đ}}\) CH3CH=CH2 + H2O
=> alkene sinh ra khi đun propan-1-ol và propan-2-ol với dung dịch sulfuric acid đặc ở nhiệt độ thích hợp đều là CH3CH=CH2.

CH3OH \(\underrightarrow{H_2SO_{4đ}}\) CH3-O-CH3 + H2O
2C2H5OH \(\underrightarrow{H_2SO_{4đ}}\) C2H5-O-C2H5 + H2O
CH3OH + C2H5OH\(\underrightarrow{H_2SO_{4đ}}\) CH3-O-C2H5 + H2O

Tham khảo:
Hiện tượng: ở đáy cốc xuất hiện chất lỏng màu vàng nhạt.
PTHH: C6H6 + HNO3 → C6H5NO2 + H2O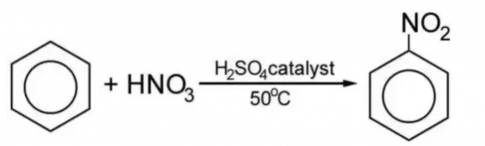
Nitrobenzen có màu vàng nhạt không tan trong nước.

- Trong Thí nghiệm 1, chất lỏng xuất hiện ở đáy cốc không phải là benzene (benzene không màu).
- Vì benzene phản ứng với dung dịch nitric acid tạo nitrobenzene có màu vàng nhạt .
PTHH: C6H6 + HNO3 → C6H5NO2 + H2O

(1) \(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
(2) \(2SO_2+O_2\xrightarrow[_{V_2O_5}]{^{t^o}}2SO_3\)
(3) \(nSO_3+H_2SO_4\rightarrow H_2SO_4.nSO_3\)
(4) \(H_2SO_4.nSO_3+nH_2O\rightarrow\left(n+1\right)H_2SO_4\)
a) 4FeS2 + 11O2 → 2Fe2O3 +8SO2 (1)
Phản ứng (1) là phản ứng oxi hoá - khử; chất oxi hoá: O2; chất khử: FeS2
2SO2 + O2 →𝑡𝑜,𝑉2𝑂5 2SO3 (2)
Phản ứng (2) là phản ứng oxi hoá - khử; chất oxi hoá: O2; chất khử: SO2
SO3 + H2O → H2SO4 (3)
Phản ứng (3) không là phản ứng oxi hoá - khử
b) 1 tấn quặng chứa 60% FeS2 (M = 120 g/𝑚𝑜𝑙−1)
Số mol FeS2 trong 1 tấn quặng trên là: 106120.60100= 5000 mol
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
Dựa trên sơ đồ có số mol H2SO4 là 2.5000 = 10 000 mol.
Khối lượng H2SO4 thu được là:
98 × 10 000 = 980 000 gam = 980 kg = 0,98 tấn.
Khối lượng H2SO4 98% thu được là: 0,9898.100=1tấn.
Do hiệu suất cả quá trình là 80% nên khối lượng H2SO4 98% thực tế thu được là:
1.80100=0,8 tấn.
c) Trong FeS2 nguyên tố S có số oxi hóa -1, đề xuất công thức cấu tạo là:

a) Phương trình hoá học của phản ứng:
NaCl + H2SO4 (đặc) → NaHSO4 + HCl (1)
2NaBr + 3H2SO4 → 2NaHSO4 + Br2 + SO2 + 2H2O (2)
b) Phản ứng (1) không có sự thay đổi số oxi hoá của các nguyên tố, H2SO4 đặc đóng vai trò là acid.
Phản ứng (2) số oxi hoá của sulfur giảm từ +6 xuống +4, sulfuric acid đóng vai trò là chất oxi hoá.