Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

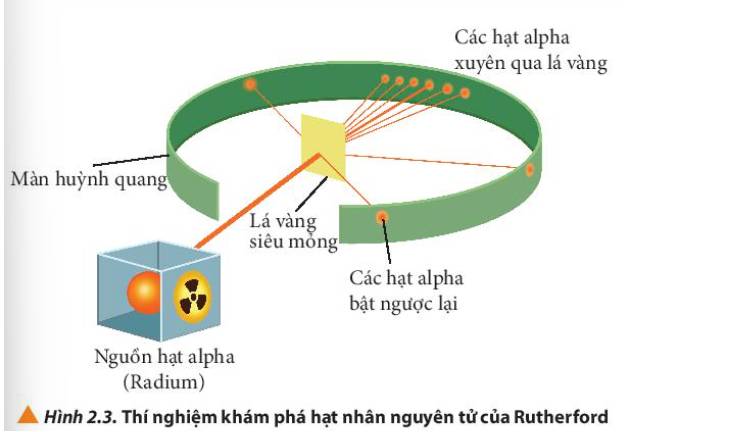
- Quan sát Hình 2.3 thấy được: hầu hết các hạt α đi thẳng, có vài hạt bị bắn theo đường gấp khúc
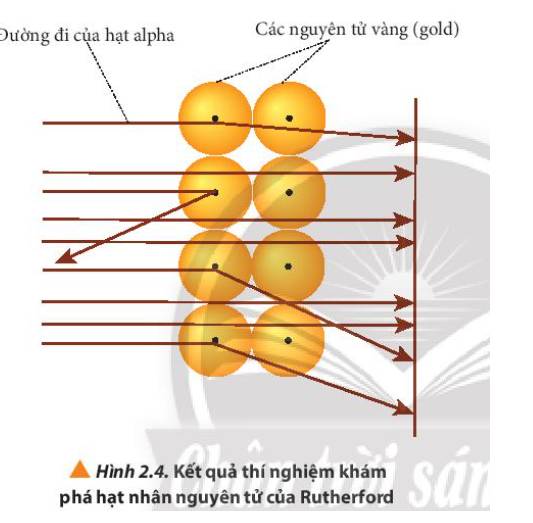
- Quan sát Hình 2.4 giải thích: các hạt α bị bắn theo đường gấp khúc là do va vào hạt nhân của nguyên tử vàng, các hạt không va vào hạt nhân thì đi thẳng
- Các hạt alpha hầu hết đều xuyên thẳng qua lá vàng, một số ít bị lệch hướng và một số rất ít bị bật ngược lại.
Giải thích: Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.

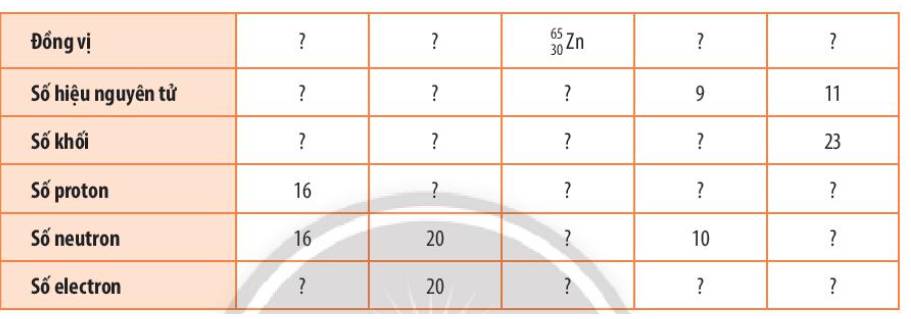
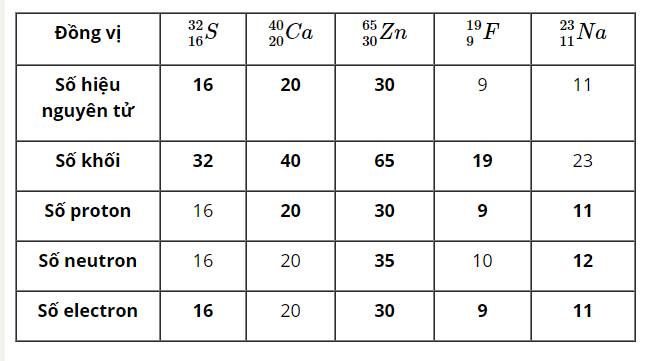
Hàng 1: \(^{32}_{16}S,^{40}_{20}Ca,^{65}_{30}Zn,^{19}_9F,^{23}_{11}Na\)
Hàng 2: 16, 20, 30, 8, 11
Hàng 3: 32, 40, 65, 18, 23
Hàng 4: 16, 20, 30, 9, 11
Hàng 5: 16, 20, 35, 10, 12
Hàng 6: 16,20,30,9,11

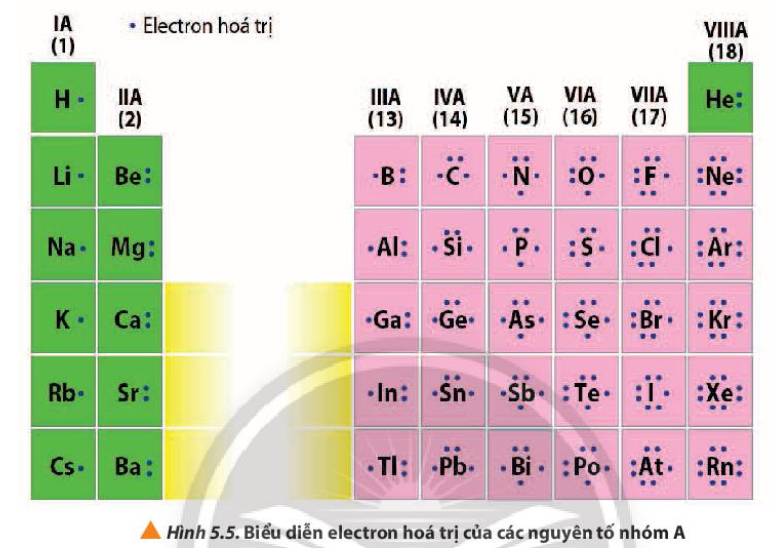
- Số electron hóa trị của nguyên tử = số thứ tự nhóm của nguyên tố nhóm A
Ví dụ:
+ Nhóm IA, các nguyên tố đều có 1 electron hóa trị
+ Nhóm IIIA, các nguyên tố đều có 3 electron hóa trị
+ Nhóm VIIIA (trừ He) các nguyên tố đều có 8 electron hóa trị

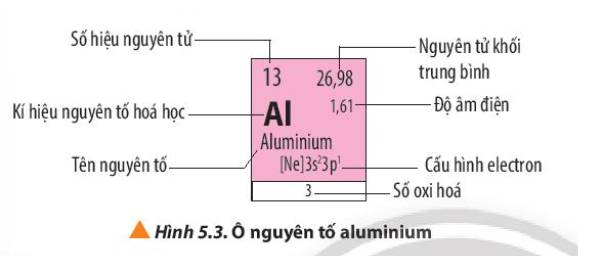
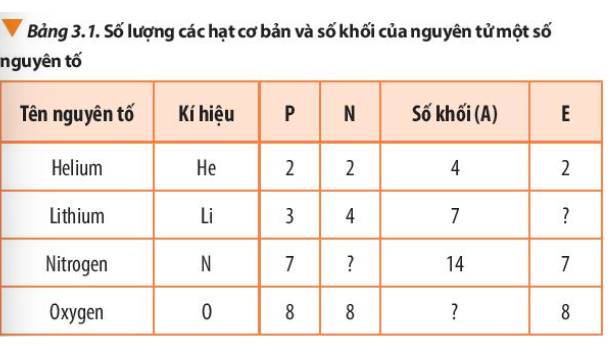
Số khối A = số proton (P) + số neutron (N)
Số electron (E) = Số proton (P)
Tên nguyên tố | Kí hiệu | P | N | Số khối (A) | E |
Helium | He | 2 | 2 | 4 | 2 |
Lithium | Li | 3 | 4 | 7 | 3 |
Nitrogen | N | 7 | 7 | 14 | 7 |
Oxygen | O | 8 | 8 | 16 | 8 |

a) Ảnh hưởng của nồng độ: Dùng bình chứa oxygen có nồng độ oxygen cao hơn không khí => Phản ứng cháy dễ dàng xảy ra
b) Ảnh hưởng của áp suất: Dùng nồi áp suất làm tăng áp suất trong nồi => Thực phẩm trong nồi áp suất sẽ nhanh chín hơn
c) Ảnh hưởng của diện tích tiếp xúc: Đậy nắp lò làm hạn chế diện tích tiếp xúc của than với oxygen trong không khí => Phản ứng cháy diễn ra chậm => Giữ than cháy được lâu hơn
d) Ảnh hưởng của nhiệt độ: Khi để thức ăn trong tủ lạnh => Nhiệt độ bị giảm => Kìm hãm phản ứng oxi hóa thức ăn => Thức ăn sẽ lâu bị ôi thiu
- Hình 16.9a) Ảnh hưởng của nồng độ đến tốc độ phản ứng:
Nồng độ oxygen trong không khí chỉ chiếm 21%. Dùng bình chứa oxygen mục đích làm tăng nồng độ chất tham gia ⇒ Tăng tốc độ phản ứng cháy
- Hình 16.9b) Ảnh hưởng của áp suất đến tốc độ phản ứng.
Dùng nồi áp suất làm tăng áp suất trong nồi ⇒ tăng tốc độ phản ứng ⇒ Làm thức ăn nhanh chín hơn.
- Hình 16.9c) Ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng.
Đậy nắp lò làm giảm diện tích tiếp xúc của than với oxygen trong không khí ⇒ Giảm tốc độ phản ứng cháy ⇒ Than cháy được lâu hơn.
- Hình 16.9d) Ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
Bảo quản thức ăn trong tủ lạnh ⇒ Giảm nhiệt độ ⇒ Giảm tốc độ phản ứng oxi hóa thức ăn ⇒ Thức ăn lâu bị ôi thiu.

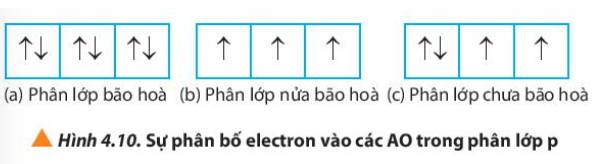
(a) Phân lớp bão hòa => Không có electron độc thân
(b) Phân lớp nửa bão hòa => Số electron độc thân = số orbital của phân lớp đó
(c) Phân lớp chưa bão hòa => số electron độc thân nhỏ hơn số orbital trong phân lớp đó
Trường hợp a) không có electron độc thân
Trường hợp b) có 3 electron độc thân
Trường hợp hợp c) có 2 electron độc thân
Nhận xét:
Phân lớp bão hòa chứa đủ số electron tối đa.
Phân lớp nửa bão hòa chứa một nửa số electron tối đa.
Phân lớp chưa bão hòa chưa đủ số electron tối đa.

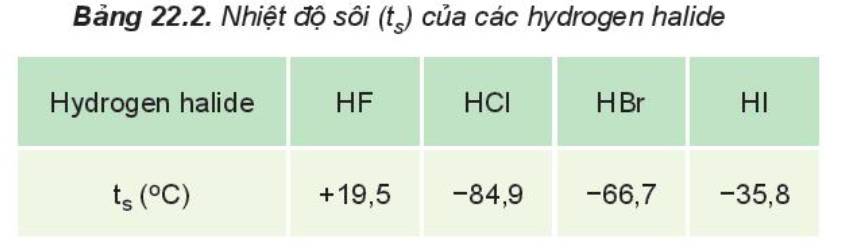
Từ Bảng 22.2 nhận thấy:
- HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: H-F…H-F…H-F
- Từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng
nhiệt độ sôi tăng từ HI đến HF là do lực tương tác van der Waals giữa các phân tử tăng và khối lượng phân tử tăng.

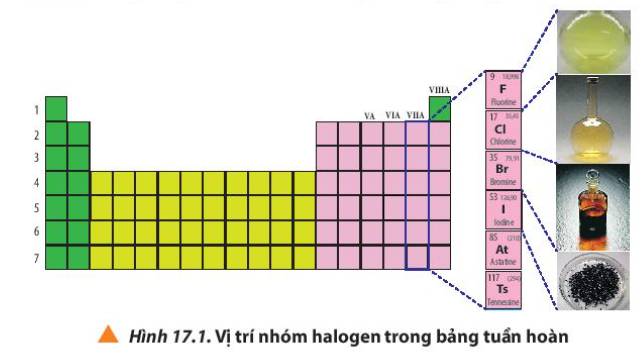

Trong tự nhiên, các halogen không tồn tại dưới dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide
Halogen trong tự nhiên không tồn tại ở dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide (F-, Cl-, Br-, I-)