Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
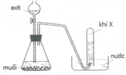
Các phương trình phản ứng điều chế các khí:
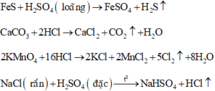
Khí X được thu bằng phương pháp đẩy nước, do đó X phải không tan hoặc ít tan trong nước
Vậy X không thể là HCl vì HCl tan nhiều trong nước

2.
R tạo hợp chất với hidro là RH nên hidroxit có thể là ROH hoặc HRO4
- TH1: ROH
%R= 35,323%
Ta có pt: \(\frac{100R}{R+17}\)= 35,323
\(\Leftrightarrow\) 100R= 35,323(R+17)
\(\Leftrightarrow\) R=9 (loại)
- TH2: HRO4
%R= 35,323%
Ta có pt: \(\frac{100R}{R+65}\)= 35,323
\(\Leftrightarrow\)100R= 35,323(R+65)
\(\Leftrightarrow\) R= 35,5.
Vậy R là clo (Cl)
1.
Trong AB3, tổng số hạt mang điện là 80 nên: 2pA+ 6pB= 80 (1)
A, B cùng nhóm A, 2 chu kì liên tiếp nên xảy ra 1 trong các TH sau:
- TH1: pA- pB=8 (2)
(1)(2)\(\rightarrow\)pA=16; pB=8 (TM)
- TH2: pA-pB= 18 (3)
(1)(3)\(\rightarrow\) pA= 23,5; pB= 5,5 (loại)
Vậy A là S, B là O. Hợp chất là SO3

Gọi số mol Fe là a
Số mol Fe2O3 là b (mol)
Rắn không tan là Cu
\(n_{Cu}=\frac{3,2}{64}=0,05\left(mol\right)\)
PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\downarrow\)
_______a--------------------------------->a_____(mol)
=> \(n_{Cu}=a\left(mol\right)\)
=> a = 0,05 (mol)
=> \(m_{Fe}=0,05.56=2,8\left(g\right)\)
=> \(m_{Fe_2O_3}=4,8-2,8=2\left(g\right)\)
b) \(n_{Fe_2O_3}=\frac{2}{160}=0,0125\left(mol\right)\)
PTHH: \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
_______0,0125-->0,075____________________(mol)
=> V dd HCl = \(\frac{0,075}{1}=0,075\left(l\right)=75ml\)

Xác định điện hoá trị và cộng hoá trị của các nguyên tố có trong hợp chất:
F2: 0
CaCl2: Ca2+ và Cl-
MgO: Mg2+ O2-
NCl3: N3+ Cl-
SiH4: Si4- và H+
K2O: K+ và O2-
N2: 0
H2O: H+ và O2-