Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.b.
\(n_{Fe}=\dfrac{2,8}{56}=0,05mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,05 0,1 0,05 ( mol )
\(V_{H_2}=0,05.22,4=1,12l\)
\(m_{HCl}=0,1.36,5=3,65g\)
c.
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,05 0,05 ( mol )
\(m_{Cu}=0,05.64=3,2g\)

a.b.c.\(n_{Al}=\dfrac{2,7}{27}=0,1mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1 0,1 0,15 ( mol )
\(V_{H_2}=0,15.22,4=3,36l\)
\(m_{AlCl_3}=0,1.133,5=13,35g\)
d.\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,15 0,1 ( mol )
\(m_{Fe}=0,1.56=5,6g\)

nAl = 2,7 : 27 = 0,1 (mol)
pthh : 2Al + 6HCl -> 2AlCl3 + 3H2
0,1 0,3 0,1 0,15
=> mAlCl3 = 0,1 . 133,5 = 13,35 (G)
=> VH2 = 0,15 . 22,4 = 3,36 (L)
pthh : CuO + H2 -t-> H2O + Cu
0,15 0,15
=> mCuO = 0,15 . 64 = 9,6 (G)

Bài 1 :
a. \(n_{Al}=\dfrac{2.7}{27}=0,1\left(mol\right)\)
PTHH : 2Al + 6HCl -> 2AlCl3 + 3H2
0,1 0,3 0,15
b. \(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
c. \(m_{HCl}=0,3.36,5=10,95\left(g\right)\)
Bài 2 :
a. \(n_{Na}=\dfrac{2.3}{23}=0,1\left(mol\right)\)
PTHH : 2Na + 2H2O -> 2NaOH + H2
0,1 0,1 0,05
b. \(V_{H_2}=0,05.22,4=1,12\left(l\right)\)
c. \(m_{NaOH}=0,1.40=4\left(g\right)\)

a) nAl = 43,2/27 = 1,6 mol
2Al + 6HCl → 2AlCl3 + 3H2
1,6 \(\dfrac{1,6\times3}{2}=2,4\)
→ nH2 = 2,4 mol → VH2 = 2,4 x 22, 4 = 53,76 lít
b) nCuO = 64/80 = 0,8 mol
nH2 = 2,4 mol
→ H2 dư, phương trình tính theo số mol của CuO
CuO + H2 → Cu + H2O
0,8 0,8 0,8 0,8
Chất rắn sau phản ứng có Cu
mCu = 0,8 x 64 = 51,2 gam

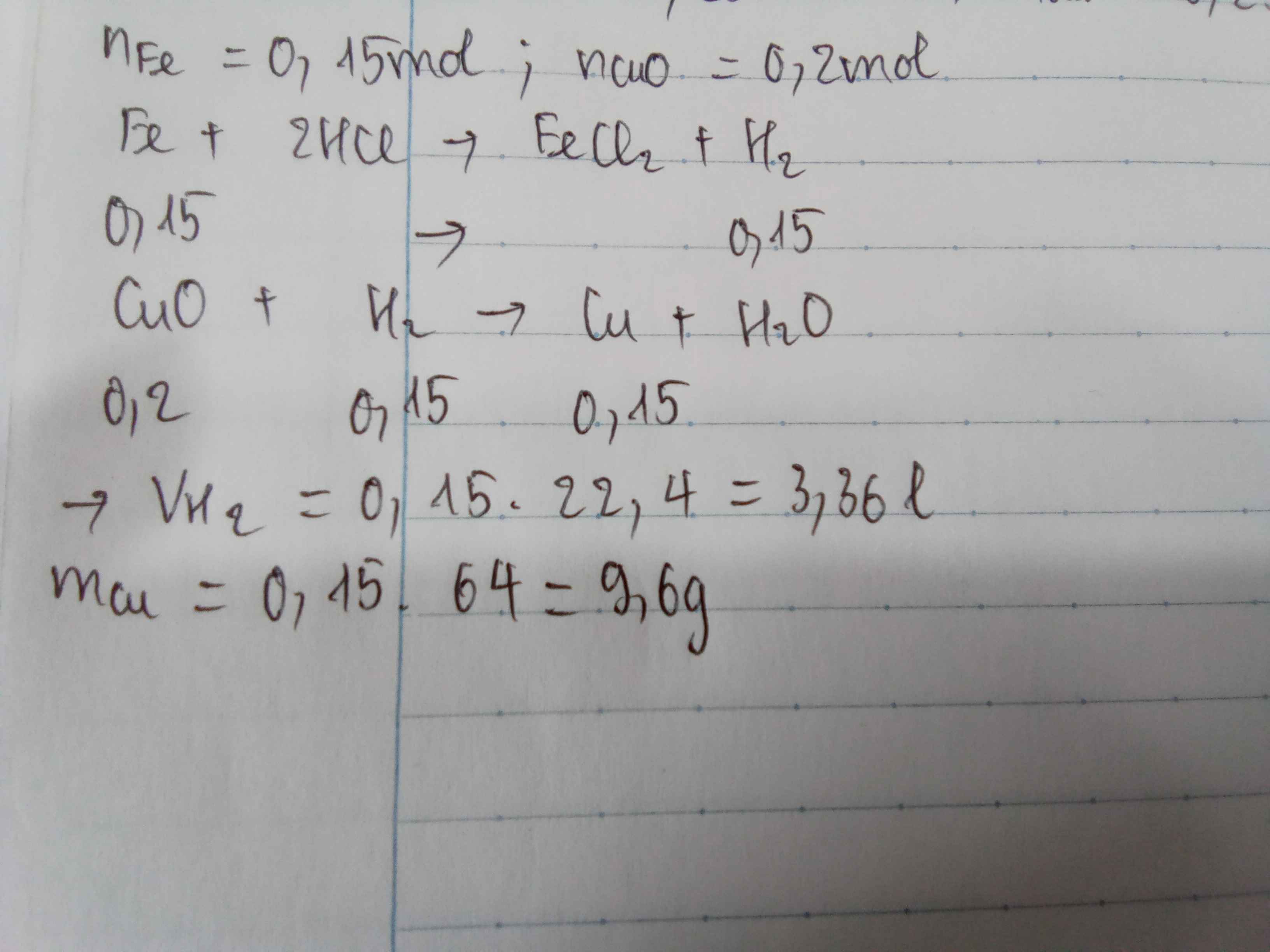

a.\(n_{HCl}=\dfrac{10,95}{36,5}=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,3 0,15 ( mol )
\(V_{H_2}=0,15.22,4=3,36l\)
b.\(n_{Fe_2O_3}=\dfrac{12}{160}=0,075mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
\(\dfrac{0,075}{1}\) > \(\dfrac{0,15}{3}\) ( mol )
0,15 0,1 ( mol )
\(m_{Fe}=0,1.56=5,6g\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
1 : 6 : 2 : 3 (mol)
0,05 : 0,3 : 0,1 : 0,15 (mol)
\(n_{HCl}=\dfrac{m}{M}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
a. \(V_{H_2\left(đktc\right)}=n.24,79=0,15.24,79=3,7185\left(l\right)\)
b. \(Fe_2O_3+3H_2\rightarrow^{t^0}2Fe+3H_2O\)
1 : 3 : 2 : 3 (mol)
0,075 : 0,15 (mol)
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{12}{160}=0,075\left(mol\right)\)
-Chuyển thành tỉ lệ: \(\dfrac{0,075}{1}>\dfrac{0,15}{3}=0,05\)
\(\Rightarrow\)H2 phản ứng hết còn Fe2O3 dư.
\(Fe_2O_3+3H_2\rightarrow^{t^0}2Fe+3H_2O\)
1 : 3 : 2 : 3 (mol)
0,05 : 0,15 : 0,1 : 0,15 (mol)
\(\Rightarrow m_{Fe}=n.M=0,1.56=5,6\left(g\right)\)