Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

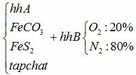
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
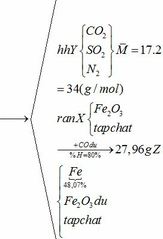
Vậy hỗn hợp Y gồm:
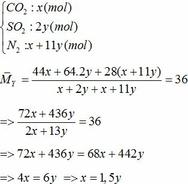
Khối lượng Fe có trong Z là:
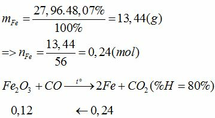
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
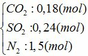
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
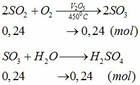
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
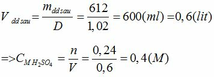

\(\overline{M}=24\cdot2=48\)
\(\dfrac{n_{SO_2}}{n_{O_2}}=\dfrac{64-48}{48-32}=1\)
\(n_{hh}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(\Rightarrow n_{SO_2}=n_{O_2}=0.15\left(mol\right)\)
\(2SO_2+O_2\underrightarrow{^{t^0,V_2O_5}}2SO_3\)
Bđ:0.15....0.15
Pư: x..........0.5x......x
KT: 0.15-x..0.15-0.5x..x
\(n_{hh}=0.15-x+0.15-0.5x+x=0.3-0.5x\left(mol\right)\)
\(m=\left(0.15-x\right)\cdot64+\left(0.15-0.5x\right)\cdot32+80x=\left(0.3-0.5x\right)\cdot2\cdot26\)
\(\Rightarrow x=\dfrac{3}{65}\)
\(H\%=\dfrac{\dfrac{3}{65}}{0.15}\cdot100\%=30.7\%\)

1.GS có 100g dd $HCl$
=>m$HCl$=100.20%=20g
=>n$HCl$=20/36,5=40/73 mol
=>n$H2$=20/73 mol
Gọi n$Fe$(X)=a mol n$Mg$(X)=b mol
=>n$HCl$=2a+2b=40/73
mdd sau pứ=56a+24b+100-40/73=56a+24b+99,452gam
m$MgCl2$=95b gam
C% dd $MgCl2$=11,79%=>95b=11,79%(56a+24b+99,452)
=>92,17b-6,6024a=11,725
=>a=0,13695 mol và b=0,137 mol
=>C%dd $FeCl2$=127.0,13695/mdd.100%=15,753%
2.Bảo toàn klg=>mhh khí bđ=m$C2H2$+m$H2$
=0,045.26+0,1.2=1,37 gam
mC=mA-mbình tăng=1,37-0,41=0,96 gam
HH khí C gồm $H2$ dư và $C2H6$ không bị hấp thụ bởi dd $Br2$ gọi số mol lần lượt là a và b mol
Mhh khí=8.2=16 g/mol
mhh khí=0,96=2a+30b
nhh khí=0,06=a+b
=>a=b=0,03 mol
Vậy n$H2$=n$C2H6$=0,03 mol

ta có dhh/H2=6--->Mtrung bình hỗ hợp khí =6*2=12
bạn dùng sơ đồ đường chéo mk làm mẫu phần a kau còn lại tương tự nha
nN2 (28) 12-2=10
nH2 (2) 12 28-12=16 ta có % thể tich = % về sô mol ----> %Vh2=\(\frac{16}{10+16}\)=61,5 %( xấp xỉ nha) %VN2 = 100-61,5=38,5%

tỉ khối là 13 chứ
nX = 0,25
n↓ = nAnkin = 0,25.20% = 0,05
=>M↓ = 147: C3H3Ag
->Ankin là C3H4 (0,05 mol)
nY = 0,2; nCO2 = 0,3
=>Số C = nCO2/nY = 1,5
Ankan là CH4
mY = mX – mC3H4 = 4,5
=>nH2O = \(\dfrac{4,5}{0,3.12}.\dfrac{1}{2}\) = 0,45
nCH4 = nH2O – nCO2 = 0,15 và nCxH2x = nY – nCH4 = 0,05
nCO2 = 0,15.1 + 0,05x = 0,3
=>x = 3
=> Anken là C3H6

\(m_Q=\left(7,7.2\right).0,1=1,54\left(g\right)\)
=> mT = 1,54 (g)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\\n_{H_2}=c\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}a+b+c=0,11\left(1\right)\\16a+28b+2c=1,54\left(2\right)\end{matrix}\right.\)
ngiảm = nH2(pư) = 0,11 - 0,1 = 0,01 (mol)
\(n_{Br_2}=\dfrac{4,8}{160}=0,03\left(mol\right)\)
Bảo toàn liên kết: b = 0,01 + 0,03 = 0,04 (mol) (3)
(1)(2)(3) => a = 0,02 (mol); b = 0,04 (mol); c = 0,05 (mol)
=> nH2(Q) = 0,05 - 0,01 = 0,04 (mol)
=> \(\%V_{H_2}=\dfrac{0,04}{0,1}.100\%=40\%\)