Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
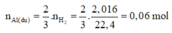
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.

8Al + 3 F e 3 O 4 → 4 A l 2 O 3 + 9Fe (1)
TH1: Al dư, vậy hỗn hợp sau phản ứng là: A l 2 O 3 , Fe, Al dư.
Gọi x và y lần lượt là số mol Al phản ứng và số mol Al dư.
2Al + 6HCl → 2AlCl3 +3 H 2 (2)
Fe + HCl → FeCl2 + H 2 (3)
Theo PTHH (1), ta có:
nFe3O4 = 3/8 . x, nFe = 9/8 . x
Theo PTHH (2) và (3), ta có:
n H 2 (2) = 3/2 . y
n H 2 (3) = 9/8 . x
Từ trên ta có hệ pt:
3
8
x
.
232
+
X
.
27
+
Y
.
27
9
8
x
+
3
2
y
+
n
H
2
⇔
114
x
+
27
y
=
9
,
66
9
8
x
+
3
2
y
=
2
,
688
22
,
4
=
0
,
12
⇔
x
=
0
,
08
m
o
l
y
=
0
,
02
m
o
l
⇒ nAl(bđ) = nAl(pư) + nAl(dư)
= x+y = 0,08+0,02=0,1 mol
⇒ mAl(bđ) = 0,1.27 = 2,7g
TH2: Fe3O4 dư, suy ra hỗn hợp sau phản ứng: A l 2 O 3 , Fe, F e 3 O 4 dư.
Gọi a, b là số mol Al phản ứng và số mol F e 3 O 4 dư.
Theo PTHH (1) ta có:
n F e 3 O 4 (pư) = 3/8 . a, nFe(sp) = 9/8 . a
Fe + 2HCl → F e C l 2 + H 2 (4)
Theo PTHH (4), ta có:
nFe(sp) = nH2 = 9a/8 = 2,688/22,4 = 0,12 mol
⇒ a = 8/75 mol
m
b
d
=
m
A
l
+
m
F
e
3
O
4
p
u
+
m
F
e
3
o
4
d
u
⇔
9
,
66
=
8
75
.
27
+
3
8
.
232
.
8
75
+
b
.
232
⇒ b = 0,01(loại)
Vậy khối lượng Al ban đầu là 2,7 gam
⇒ Chọn B.

TK
2Al+Fe2O3to→Al2O3+2Fe2Al+Fe2O3→toAl2O3+2Fe
Hỗn hợp sau phản ứng gồm A12O3, Fe, Al và Fe2O3.
Khi cho hỗn hợp vào dung dịch NaOH dư thì chỉ có Al và A12O3 tan, chất rắn còn lại gồm Fe và Fe2O3

nSO2=0,1mol
nFe2(SO4)3=,3mol
PTHH:
2FexOy + (6x-2y)H2SO4 ---> xFe2(SO4)3 + (3x-2y)SO2 + (6x-2y)H2O
ta có phương trình từ PTHH trên là :
\(\frac{0,2x}{3x-2y}=0,3\)
<==> 0,2x=0,9x-0,6y
<=> 0,6y=0,7x
=> x:y=7:6=> VTHH của oxit sắt là Fe7O6

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

Bảo toàn e cho toàn quá trình.
Chất khử là Al,chất oxh là N+5
đặt số mol NO2l= là x, NÓ là y.
Ta có
-theo bài ra : x+y=0,04
-theo bảo toàn e : x+3y=(0,54/27)*3=0,06
giải ra đươc x=0,03 y=0,01
M hh khí = (0,03*46+0,01*30)/0,04=42
tỉ khối = 21
$n_{Al} = 0,2(mol) ; n_{Fe_3O_4} = 0,075(mol)$
$8Al + 3Fe_3O_4 \xrightarrow{t^o} 9Fe + 4Al_2O_3$
Vì $n_{Al} : 8 = n_{Fe_3O_4} : 3$ nên gọi hiệu suất là a
Suy ra: $n_{Al\ pư} = 0,2a(mol) ; n_{Al\ dư} = 0,2 - 0,2a(mol)$
$n_{Fe} = \dfrac{9}{8}n_{Al} = 0,225a(mol)$
Mà :
$n_{H_2} = 1,5n_{Al} + n_{Fe} = 1,5(0,2 - 0,2a) + 0,225a = \dfrac{5,376}{22,4}$
$\Rightarrow a = 0,8 = 80\%$